Czy prehabilitacja ma wpływ na wystąpienie zakażenia miejsca operowanego?
Czy prehabilitacja ma wpływ na wystąpienie zakażenia miejsca operowanego?
Prehabilitacja to przygotowanie organizmu przed leczeniem także przedoperacyjnym, który ma na celu optymalizację stanu zdrowia przed zabiegiem. Wszystko po to, aby zabieg przebiegł bez komplikacji i powikłań a pacjent mógł szybciej wrócić do stanu sprzed choroby.
Ryzyko infekcji pooperacyjnych
Infekcje pooperacyjne to jedno z potencjalnych powikłań po operacji. Mogą wystąpić na miejscu operowanym lub w innych obszarach ciała. Szczególnie narażone są na nie osoby starsze, z występującymi chorobami oraz osoby niedożywione. Powikłania u takich osób mogą w skrajnych przypadkach prowadzić nawet do zgonu pacjenta. W Polsce w skutek powikłań pooperacyjnych umiera kilkanaście tysięcy pacjentów.
Jak zapobiec powikłaniom pooperacyjnym?
Szczególnie istotne jest odpowiednie przygotowanie organizmu do wdrażanego leczenia. Interwencja chirurgiczna to dla organizmu nie małe wyzwanie, z którym musi się zmierzyć i przebyć tę drogę z jak najlepszym efektem. Aby proces ten przebiegł pomyślnie, pacjent musi mieć odpowiedni zapas energii, która dostarczana jest wraz z dietą. W celu zapewnienia odpowiedniej ilości składników odżywczych zaleca się stosowanie żywności specjalnego przeznaczenia medycznego Immuven, który w swoim składzie posiada immunoskładniki pomagające wzmocnić odporność. Wdrożenie żywności medycznej należy skonsultować z lekarzem lub dietetykiem.
Posłuchaj, co na ten temat mówi specjalistka ds. leczenia ran, pielęgniarka, prof. dr hab. n. med. Tomasz Banasiewicz.

Immuven
Kompozycja niezbędnych składników pokarmowych – białek, węglowodanów, tłuszczów, witamin, mikro- i makroelementów, a także kwasy omega-3, L-arginina i beta-1,3/1,6 glukan niezbędnych w okresie okołooperacyjnym.
Niezawodny partner prehabilitacji.
Jakie składniki odżywcze pomagają w procesie gojenia ran?
Jakie składniki odżywcze pomagają w procesie gojenia ran?
Zapewnienie odpowiednich składników odżywczych w diecie jest istotne dla prawidłowego procesu gojenia się ran.
Czym jest rana?
Rana to uszkodzenie lub przerwanie ciągłości tkanki ciała, spowodowane przez różne czynniki, takie jak urazy, operacje chirurgiczne, oparzenia czy owrzodzenia. Rany mogą być powierzchowne, czyli obejmować tylko górne warstwy skóry lub głębokie, dotykające także tkanki podskórne, mięśnie, kości lub narządy wewnętrzne.
Składniki kluczowe w gojeniu się ran
Oto kilka kluczowych składników, które są niezbędne dla gojenia się ran:
- Białko jest niezwykle ważne dla gojenia się ran, ponieważ jest podstawowym składnikiem budulcowym tkanek. Spożywanie odpowiedniej ilości białka pomaga w odbudowie i regeneracji tkanek. Źródła białka to mięso, ryby, jaja, nabiał, rośliny strączkowe i orzechy.
- Arginina, jest niezbędna do syntezy tlenku azotu, który ma działanie przeciwpłytkowe i przeciwdziała skurczowi naczyń krwionośnych, co przyczynia się do lepszego ukrwienia obszaru rany i dostarczenia składników odżywczych. Arginina wpływa także na produkcję kolagenu – kluczowego składnika strukturalnego skóry i tkanek.
- Witamina C jest niezbędna do syntezy kolagenu, który jest niezbędny dla utrzymania struktury i elastyczności tkanek. Znajduje się w owocach cytrusowych, jagodach, kiwi, papryce, zielonymi warzywami liściastymi i pomidorach.
- Witamina A jest istotna dla wzrostu i różnicowania komórek, w tym dla gojenia się tkanek. Dobre źródła witaminy A to marchew, dynia, słodki ziemniak, jajka, szpinak i wątróbka.
- Cynk jest niezbędny do produkcji kolagenu i enzymów zaangażowanych w regenerację tkanek. Znajduje się w mięsie, rybach, nasionach dyni, orzechach, pełnoziarnistych produktach zbożowych i nabiale.
- Kwasy tłuszczowe omega-3 wykazują właściwości przeciwzapalne i przyspieszają proces gojenia się ran. Dobre źródła to tłuste ryby (łosoś, makrela, sardynki), siemię lniane, orzechy włoskie i nasiona chia.
- Nawodnienie organizmu ma istotne znaczenie dla utrzymania odpowiedniej wilgotności tkanek i zapewnienia prawidłowego transportu składników odżywczych do rany. Właściwe nawodnienie pomaga w procesie gojenia się ran.
Pamiętaj, że każda rana jest inna i indywidualne potrzeby mogą się różnić. W przypadku poważnych lub opornych ran zawsze warto skonsultować się z lekarzem lub dietetykiem w celu dostosowania diety do swoich potrzeb.
Posłuchaj, co na ten temat mówi specjalistka ds. leczenia ran, pielęgniarka, mgr Zuzanna Konrady.

Immuven
Kompozycja niezbędnych składników pokarmowych – białek, węglowodanów, tłuszczów, witamin, mikro- i makroelementów, a także kwasy omega-3, L-arginina i beta-1,3/1,6 glukan niezbędnych w okresie okołooperacyjnym.
Niezawodny partner prehabilitacji.
Jaka jest rola probiotyków w chorobach zapalnych jelit?
Jaka jest rola probiotyków w chorobach zapalnych jelit?
Probiotyki to żywe mikroorganizmy, które dostarczane do organizmu w odpowiedniej ilości i formie, wpływają pozytywnie na mikrobiotę jelitową i zdrowie.
Czym jest mikrobiota jelitowa?
Mikrobiota jelitowa to złożona społeczność mikroorganizmów, w tym bakterii, wirusów, grzybów i innych drobnoustrojów, które zamieszkują jelita. Mikrobiota jelitowa pełni wiele ważnych funkcji, w tym bierze udział w trawieniu, syntezie witamin, wchłanianiu składników odżywczych, regulacji funkcjonowania układu odpornościowego i utrzymaniu homeostazy. Probiotyki wpływają na mikrobiotę jelitową poprzez zwiększenie ilości korzystnych bakterii, a także produkcję metabolitów, które korzystnie wpływają na zdrowie jelit.
Jaki wpływ mają probiotyki na stan zapalny jelit?
W chorobach zapalnych jelit, takich jak np. choroba Leśniowskiego-Crohna czy wrzodziejące zapalenie jelita grubego, probiotyki mogą pomóc w zmniejszeniu objawów choroby. Mogą być nimi biegunka, ból brzucha czy krwawe stolce. Wpływ probiotyków na choroby zapalne jelit zależy jednak od indywidualnych cech organizmu i typu choroby.
Ważne jest, aby wybierać odpowiednie probiotyki, które zawierają szczepy bakterii o udowodnionym działaniu w chorobach zapalnych jelit. Probiotyki nie zawsze są odpowiednie dla każdego pacjenta z chorobą zapalną jelit, dlatego przed rozpoczęciem suplementacji należy skonsultować się z lekarzem.
Posłuchaj, co na ten temat mówi prof. dr hab. n. med. Tomasz Banasiewicz.

Immuven
Kompozycja niezbędnych składników pokarmowych – białek, węglowodanów, tłuszczów, witamin, mikro- i makroelementów, a także kwasy omega-3, L-arginina i beta-1,3/1,6 glukan niezbędnych w okresie okołooperacyjnym.
Niezawodny partner prehabilitacji.
Chemioterapia i radioterapia a nietolerancja laktozy – czy ma to związek?
Chemioterapia i radioterapia a nietolerancja laktozy – czy ma to związek?
Dietoterapia w onkologii cieszy się coraz większym zainteresowaniem społecznym, co ułatwia propagowanie wiedzy na temat żywienia w chorobie nowotworowej. Z drugiej jednak strony tematyka ta obarczona jest wieloma mitami żywieniowymi. Zjawisko to sprawia, że chorzy niepotrzebnie stosują diety eliminacyjne na własną rękę i bez wcześniejszej konsultacji ze specjalistą. Działanie to ogranicza asortyment produktów spożywczych i może zwiększać ryzyko utraty masy ciała. Jednym z częściej poruszanych tematów w gabinecie onkodietetyka jest zasadność stosowania diety bezlaktozowej. Co prawda nie każdy chory musi eliminować laktozę ze swojej diety, ale pewne schematy leczenia onkologicznego mogą przyczyniać się do wystąpienia wtórnej nietolerancji laktozy. Nawet jeżeli przed chorobą pacjent nie miał problemów z tolerancją laktozy, podczas chemioterapii lub radioterapii stan ten może ulec zmianie.
Laktoza i jej źródła w diecie
Laktoza, powszechnie znana jako cukier mleczny, z punktu widzenia chemicznego jest organicznym związkiem z grupy węglowodanów. Zbudowana jest z dwóch cukrów prostych – D-glukozy i D-galaktozy, połączonych wiązaniem beta-1,4-glikozydowym. Źródłem tego dwucukru jest mleko ssaków oraz przetwory. W związku z powyższym laktoza występuje nie tylko w mleku krowim, ale również w owczym i kozim.
Nietolerancja laktozy
Trawienie laktozy odbywa się w jelicie cienkim. Enterocyty rąbka szczoteczkowego produkują laktazę, czyli enzym rozkładający laktozę do glukozy i galaktozy, które następnie są wchłaniane do krwioobiegu. Przyczyną nietolerancji laktozy jest brak (alaktazja) lub niedobór laktazy, spowodowany hipolaktazją rozwijającą się z wiekiem, lub wtórnym niedoborem laktazy, związanym z jednostką chorobową (np. celiakii) lub zastosowanym leczeniem (np. radioterapią lub chemioterapią).
W przypadku każdej postaci nietolerancji laktozy, cukier ten pozostaje nierozłożony w przewodzie pokarmowym. Podnosi to ciśnienie osmotyczne w jelitach, gdzie objętość wody zwiększa się. W efekcie pojawiają się dolegliwości ze strony przewodu pokarmowego: biegunki, gazy, bóle brzucha, uczucie przepełnienia i „przelewania się” w jamie brzusznej, a także nudności i wymioty. Objawy te występują po spożyciu produktu będącego źródłem laktozy.
Wtórna nietolerancja laktozy w trakcie leczenia onkologicznego
Zgodnie ze standardami leczenia żywieniowego w onkologii, nie ma wskazań do rutynowej eliminacji laktozy z diety u chorych onkologicznych. Jednakże w trakcie leczenia, na skutek uszkodzenia enterocytów rąbka szczoteczkowego, może rozwijać się wtórna nietolerancja laktozy. Dotyczy to chorych poddawanych chemioterapii i immunoterapii, z zastosowaniem leków tj. 5-fluorouracyl, irynotekan, inhibitory kinaz tyrozynowych, ipilimumab i niwolumab. Szczególną grupą są również pacjenci poddawani radioterapii na obszar jamy brzusznej i miednicy, gdzie obszar napromieniania może obejmować jelita. W postępowaniu żywieniowym stosowanie wyżej wymienionych metod leczenia jest wskazaniem do stosowania diety nisko- lub bezlaktozowej. Uzasadnione jest również stosowanie diety bezlaktozowej u chorych z wcześniej rozpoznaną nietolerancją laktozy.
Postępowanie żywieniowe
Decyzja o zastosowaniu diety bezlakozowej lub niskolaktozowej powinna być poprzedzona konsultacją ze specjalistą, w oparciu o przeprowadzony wywiad medyczno-żywieniowy i wyniki badań chorego. Nietolerancja laktozy nie zawsze oznacza konieczność całkowitego wykluczenia laktozy z diety, ponieważ pojedyncza dawka 5g laktozy zazwyczaj jest dobrze tolerowana i nie powoduje dolegliwości. W tabeli 1. zestawiono zawartość laktozy w 100g oraz w przeliczeniu na daną porcję produktu mlecznego. Osoby z nietolerancją laktozy prawdopodobnie będą zgłaszały objawy po spożyciu całego opakowania serka wiejskiego lub szklance świeżego mleka. Natomiast dodatek łyżki śmietany lub plastra żółtego sera nie powinien być problematyczny. Co więcej, niektórzy pacjenci nie obserwują zaostrzenia objawów po produktach mlecznych fermentowanych tj. jogurt, kefir, maślanka. Są one źródłem probiotyków, które wspomagają trawienie laktozy.
Z diety należy wykluczyć produkty mleczne o najwyższej zawartości laktozy, czyli mleko w proszku i świeże mleko (krowie, owcze i kozie). Dobrym zamiennikiem jest mleko bezlaktozowe oraz napoje roślinne (np. napój migdałowy, ryżowy, owsiany, kokosowy). Pamiętać jednak należy, aby wybierać napoje fortyfikowane w wapń. Produkty mleczne są doskonałym źródłem wapnia, a zmniejszenie ich spożycia zwiększa ryzyko jego niedoboru. Dobrym źródłem tego składnika są również woda wysokozmineralizowana (wysokowapniowa), sardynki, szprotki, nasiona chia, migdały, sezam, siemię lniane, mak i komosa ryżowa.
Chory z nietolerancją laktozy mogą korzystać z całego asortymentu produktów bezlaktozowych, które są powszechnie dostępne w większości sklepów spożywczych. W diecie należy ograniczyć lub wyeliminować tradycyjne „laktozowe” produkty, czyli śmietanę, biały ser, lody na bazie mleka i śmietany, czekolady mleczne, słodycze i desery na bazie mleka, dipy i sosy zrobione na jogurcie lub śmietanie. Należy również mieć na uwadze, że laktoza jest często dodawana do gotowych produktów spożywczych (a nawet leków i suplementów diety), dlatego osoby z nietolerancją laktozy powinny dokładnie czytać etykiety. Laktoza może znajdować się m.in. w pieczywie (zwłaszcza maślanym), gotowych płatkach śniadaniowych, daniach instant (np. gotowy budyń, kasza manna) oraz przetworach mięsnych.
Stosując żywność specjalnego przeznaczenia medycznego, należy sprawdzić, czy jest ona wolna klinicznie od laktozy, jak np. Nutramil Complex i Nutramil Complex Protein firmy Olimp Labs. Produkty te zawierają białko serwatkowe i kazeinian wapnia, ale pomimo, że są to białka naturalnie występujące w mleku, produkty te są wolne klinicznie od laktozy i ich spożycie nie powoduje objawów ze strony przewodu pokarmowego u chorych z nietolerancją laktozy.
W przypadku chorych onkologicznych zaleca się kontynuację diety przez 2-3 miesiące po zakończeniu terapii, a stopień restrykcji jest uzależniony od indywidualnej tolerancji chorego. Rozszerzanie i bilansowanie diety powinno odbywać się pod nadzorem wykwalifikowanego dietetyka.
Podsumowanie
Leczenie onkologiczne jest obarczone ryzykiem pojawienia się szeregu działań niepożądanych. Niektóre z nich obejmują dolegliwości ze strony przewodu pokarmowego, tj. biegunka, wzdęcia, bóle brzucha. Czasem ich przyczyną jest uszkodzenie enterocytów rąbka szczoteczkowego w trakcie chemio- i radioterapii, co prowadzi do wystąpienia wtórnej nietolerancji laktozy. Stanowi to wskazanie do stosowania diety nisko- lub bezlaktozowej. Pamiętać jednak należy, że jej stosowanie oraz zbilansowanie powinno być poprzedzone konsultacją ze specjalistą.
Autor: dr n. med. Magdalena Maciejewska-Cebulak, Doktor nauk medycznych, dietetyk medyczny, psycholog
Literatura:
1. Fassio F., Facioni MS., Guagnini F., Lactose maldigestion, malabsorption, and intolerance: A comprehensive review with a focus on current management and future perspectives, Nutrients 2018, 10, 1590.
2. Gromadzka-Ostrowska J., Paluszkiewicz P., Słodkowski M., Sobocki J., Szawłowski A. (red.), Żywienie w chorobach nowotworowych, PZWL Wydawnictwo Lekarskie, 2020.
3. Kłęk S. i wsp., Standardy leczenia żywieniowego w onkologii, Onkol Prakt Klin Edu 2015, 1(1):19-36.
4. Włodarek D., Głąbska D., Nietolerancja laktozy – zalecenia dietetyczne, Medical Tribune 2014, 10.
5. Kolasa K., Nietolerancja laktozy – co warto wiedzieć?, Journal of NutriLife, 2022, 09.
6. Kuchanowicz H., Przygoda B., Nadolna I., Iwanow K., Tabele składu i wartości odżywczej żywności, PZWL Wydawnictwo Lekarskie, 2017.

Nutramil Complex Protein
Żywność specjalnego przeznaczenia medycznego przeznaczona do stosowania w chorobie nowotworowej, w przypadku niedożywienia, problemów z gryzieniem i przełykaniem, w okresie okołooperacyjnym oraz we wszystkich stanach chorobowych ze zwiększonym zapotrzebowaniem na białko. Produkt klinicznie wolny od laktozy.
Mity w diecie osoby chorej na nowotwór
Mity w diecie osoby chorej na nowotwór
Czy istnieje dieta, która mogłaby całkowicie ochronić przed zachorowaniem na nowotwór? Czy istnieje dieta lecząca i wspomagająca leczenie?
W chwili obecnej nie ma konkretnej diety, która całkowicie chroniłaby przed chorobą nowotworową. A wokół sposobów żywienia urosła cała masa mitów. Odpowiednie żywienie ma znaczenie nie tylko w profilaktyce, ale również w czasie choroby. Wsparcie żywieniowe pacjenta pozwala często na osiągnięcie lepszej skuteczności leczenia i powinno być integralnym elementem każdego etapu terapii – im szybciej rozpoczęte, tym lepiej. Postępowaniem pierwszego rzutu jest poradnictwo dietetyczne oraz doustne diety przemysłowe (ONS).
Pacjent onkologiczny oraz jego bliscy nieustannie poszukują skutecznych metod terapii. Zdarza się wówczas, że stosują nie zawsze sprawdzone i skuteczne metody leczenia. Zwłaszcza kiedy tradycyjna opieka zawodzi bądź nie oferuje żadnych rozwiązań. Łatwo wpaść w spirale błędnego koła bądź po prostu trafić na nieuczciwe osoby. Wiele się mówi o tym, co powinna jeść osoba chora, a czego nie, które produkty żywnościowe wspierają terapię przeciw rakową, które suplementy powinno się przyjmować.
Cudowny suplement? Dieta eliminacyjna: bez glutenu, laktozy? A może eliminacja białka? Łatwo zbłądzić w gąszczu często sprzecznych informacji. Poniżej kilka mitów, szczegółowo wyjaśnionych i popartych dowodami naukowymi.
Mit 1: Białko żywi raka
Białko odgrywa bardzo ważną rolę w diecie pacjenta onkologicznego ponieważ u chorego wzrasta zapotrzebowanie na ten składnik diety. Specjaliści od żywienia są zgodni, że w przebiegu większości chorób (w tym chorób nowotworowych) kluczowym składnikiem diety powinno być białko. A podaż tego makroskładnika u dorosłego człowieka powinna wynosić od: 0,8–1,5 g/kg m.c./dobę. Bardzo wyniszczeni chorzy powinni otrzymywać podaż białka nawet do 2–3 g/kg m.c./dobę
Białko wspiera układ odpornościowy pacjenta, jest niezwykle istotne w procesie budowy i regeneracji komórek, pomaga uniknąć utraty masy mięśniowej, wpływa pozytywnie na równowagę płynów w organizmie i zwiększa zdolność do gojenia się ran. Dlatego odpowiedni poziom w organizmie ma ogromne znaczenie w procesie leczenia. Białko pełni więc wiele ważnych funkcji i bez niego organizm człowieka nie może funkcjonować prawidłowo. Zdarzają się jednak wyjątkowe sytuacje, kiedy podaż białka musi zostać ograniczona (np. niewydolność nerek lub wątroby). Warto pamiętać, że o podaży białka w diecie powinien zadecydować lekarz onkolog, lekarz specjalizujący się w żywieniu klinicznym, bądź wyspecjalizowany dietetyk.
Mit 2: Brak apetytu w chorobie nowotworowej jest normalny
Brak apetytu niejednokrotnie postrzegany jest jako naturalny element choroby, nie wymagający interwencji z zewnątrz. W rzeczywistości brak łaknienia to następstwo zmian zachodzących w organizmie dotkniętym chorobą oraz jeden z niepożądanych efektów ubocznych leczenia. Taki stan to wyraźny sygnał aby zareagować, by nie doprowadzić do wyniszczenia organizmu.
Odpowiednio wcześnie przeprowadzona konsultacja z lekarzem lub dietetykiem, zmiana diety i/lub dodanie żywienia medycznego może pozytywnie wpłynąć na stopień odżywienia, ograniczając tym samym jego niekorzystny wpływ na terapię. Żywienie medyczne powinno być integralną częścią leczenia onkologicznego.
Mit 3: W trakcie leczenia unikaj laktozy!
Nie ma wskazań do rutynowego stosowania diet bez laktozowych u chorych leczonych onkologicznie. Nietolerancja laktozy, która powstaje na skutek leczenia cytostatykami lub na skutek radioterapii, ma charakter wtórny i związany z uszkodzeniem funkcji nabłonka jelitowego. Jeżeli jednak w okresie chemioterapii lub radioterapii dojdzie do nietolerancji mleka związanego z uszkodzeniem enzymu rozkładającego cukier mleczny i pojawią się dolegliwości bólowe, należy ten produkt wyeliminować z diety na jakiś czas. Zazwyczaj w tym czasie dobrze tolerowane są mleczne produkty fermentowane – jogurt, kefir czy twaróg – ze względu na zmniejszoną w ich składzie ilość cukru mlecznego – laktozy.
Nie każda chemioterapia czy radioterapia będzie powodowała konieczność wyłączenia mleka z diety!
Mit 4: W czasie chemioterapii należy stosować dietę bezglutenową
Dietę bezglutenową stosuje się u niewielkiej grupy pacjentów onkologicznych, przede wszystkim chorych na celiakię oraz w przypadku osób z popromiennym zapaleniem jelit, będącym możliwym działaniem niepożądanym po radioterapii. Produkty zawierające gluten (pszenica, żyto, jęczmień, owies) to nie tylko doskonałe źródła węglowodanów, ale również białka, witamin z grupy B, witaminy E, żelaza, magnezu, potasu, wapnia, selenu i cynku. Dieta bezglutenowa bez wyraźnych wskazań lekarza czy dietetyka może doprowadzić do utraty masy ciała i bardzo osłabić organizm. Podejmowanie bez wyraźnych wskazań ze strony lekarza lub dietetyka tego typu diet w czasie chemio- i radioterapii może zaszkodzić pacjentowi.
Mit 5: Obowiązkowa suplementacja multiwitaminami
Czy w chorobie nowotworowej trzeba brać witaminy i antyoksydanty na wzmocnienie? Absolutnie nie! Zgodnie z zaleceniami zarówno ESPEN, National Institute for Health and Clinical Excellence (NICE), jak i większości towarzystw dietetycznych na świecie nie ma wskazań do rutynowej suplementacji witamin czy minerałów u pacjentów chorujących na nowotwór złośliwy. Stosowanie jakichkolwiek związków aktywnych wskazane jest wyłącznie w stanach udowodnionego niedoboru. Niektóre substancje stosujemy też na podstawie znajomości metabolizmu i obrazu niedoborów w konkretnych sytuacjach klinicznych. Nic na własną rękę!
Autor: mgr Aleksandra Kasprowicz-Grasiak, dietetyk kliniczny
Literatura:
1. Kłęk S., Jarosz J., Jassem J., Kapała A., Krawczyk J., Krzakowski M., Misiak M., Szczepanek K., Polskie Rekomendacje Żywienia Dojelitowego i Pozajelitowego w Onkologii – część II: żywienie drogą przewodu pokarmowego (żywienie dojelitowe), Onkologia w praktyce klinicznej; 2013
2. Baldwin C., Parsons T., Logan S. Dietary advice for illness-related malnutrition in adults. Cochrane Database of Syst. Rev.; 2001
3. Milne A.C., Pooter J., Vivanti A., Avanell A. Protein and energy supplementation in elderly people at risk from malnutrition. Cochrane Database Syst. Rev.; 2009
4. Podstawy żywienia klinicznego, Sobotka L. (red.) Scientifica, Kraków; 2013
5. Kłęk S., Jankowski M., Kruszewski WJ., Standardy leczenia żywieniowego w onkologii. Onkol Prakt Klin. 2015
6. Jachnis A, Kapała A. Zastosowanie diety bezlaktozowej u chorych poddanych leczeniu z powodu choroby nowotworowej.
7. Brzegowy M., Turek K., Maciejewska-Cebulak M. Nie Daj Się Rakowi! Wsparcie Żywieniowe W Chorobie Nowotworowej; Zdrowe Zdrowie; 2018

Nutramil Complex Protein
Żywność specjalnego przeznaczenia medycznego przeznaczona do stosowania w chorobie nowotworowej, w przypadku niedożywienia, problemów z gryzieniem i przełykaniem, w okresie okołooperacyjnym oraz we wszystkich stanach chorobowych ze zwiększonym zapotrzebowaniem na białko.
Talerz bariatryczny – czyli jak komponować posiłki?
Talerz bariatryczny – czyli jak komponować posiłki?
Otyłość to choroba, którą można leczyć na wiele sposobów. Jeśli natomiast mówimy o otyłości olbrzymiej, tutaj najczęściej dochodzi do operacyjnego leczenia, czyli operacji bariatrycznej. Tylko jak po takiej operacji utrzymać efekt na dłużej? Co jeść, aby cały proces leczenia był skuteczny?
Otyłość w skali BMI
Epidemia otyłości z roku na rok mocno przybiera na sile. Dotyka osoby w każdym wieku i wynika ze spożywania zbyt dużej ilości kcal w stosunku do zapotrzebowania. Aby ocenić poziom otyłości Światowa Organizacja Zdrowia określiła zakres BMI (masa ciała w kg/wzrost w m*2).
- < 16 = wygłodzenie,
- 16 – 16,99 = wychudzenie,
- 17 – 18,49 = niedowaga,
- 18,5 – 24,99 = wartość prawidłowa,
- 25 – 29,99 = nadwaga,
- 30 – 34,99 = otyłość I stopnia,
- 35 – 39,99 = otyłość II stopnia,
- > 40 = otyłość III stopnia.
W przypadku otyłości 3 stopnia, mówimy o otyłości olbrzymiej, która kwalifikuje się do operacji bariatrycznej, czyli chirurgicznego leczenia otyłości.
Operacja bariatryczna
Szansą na skuteczne leczenie pacjentów z otyłością olbrzymią (BMI > 40 bądź BMI > 35 z powikłaniami metabolicznymi) stają się zabiegi bariatryczne, polegające na częściowym wyłączeniu bądź resekcji żołądka. Wyróżniamy kilka rodzajów operacji, jednak łączy ich jeden cel: zredukowanie objętości żołądka, aby szybciej odczuwać sytość po zjedzeniu posiłku, zmniejszyć ilości przyjmowanych posiłków i w końcowym efekcie zredukować masę ciała.
Co jeść po operacji bariatrycznej?
Z odpowiedzią przychodzi talerz bariatryczny.


Immuven
Kompozycja niezbędnych składników pokarmowych – białek, węglowodanów, tłuszczów, witamin, mikro- i makroelementów, a także kwasy omega-3, L-arginina i beta-1,3/1,6 glukan niezbędnych w okresie okołooperacyjnym.
Niezawodny partner prehabilitacji.
Poradnik Żywieniowy w procesie leczenia ran
Wypełnij formularz i odbierz ebooka

Olimp Labs
Poradnik żywieniowy w procesie leczenia ran
Gojenie rany to wieloetapowy i często skomplikowany proces, wymagający odpowiedniego zaopatrzenia w tlen i substancje odżywcze. Organizmowi niedożywionemu znacznie trudniej będzie zregenerować powstałe zmiany skórne, dlatego należy pamiętać o jakże istotnym znaczeniu żywienia.
Następstwem niedożywienia jest:
- nieprawidłowe gojenie się ran,
- wzrost częstości zakażeń, wzrost częstości powikłań pochorobowych,
- wydłużenie pobytu w szpitalu i rekonwalescencji,
- wzrost kosztów leczenia.
Poradnik żywieniowy w procesie leczenia ran powstał w celu pokazania wskazówek żywieniowych oraz istoty żywienia jako wspomagacza w trakcie gojenia ran. Przygotowane opisy, grafiki i schematy oparte są na wiedzy doświadczonego personelu medycznego oraz na badaniach naukowych. Przykładowy jadłospis to zbiór posiłków, które zostały dokładnie skomponowane, tak aby zapewnić organizmowi najważniejszych w okresie leczenia substancji odżywczych. Jakie to substancje, co jest istotne, jak zadbać o ranę i wiele więcej, przeczytasz w poradniku.
Przyjmuje się, że utrata już zaledwie 10% beztłuszczowej masy ciała wiąże się z upośledzoną odpornością i zwiększonym ryzykiem infekcji.

Arginilan
Arginilan zapewnia uzupełnienie diety w L-argininę,
hydrolizat kolagenu, cynk, witaminę A i C,
w celu m.in. poprawy kondycji skóry.
Co przynieść choremu do szpitala?
Co przynieść choremu do szpitala?
Ciasta z dala od szpitala – czyli co przynieść choremu przebywającemu w szpitalu. Wybierasz się na wizytę do szpitala do bliskiej Ci osoby? Zastanawiasz się, co może jeść, co nie zaszkodzi w procesie rekonwalescencji i będzie dobrze przyswajalne?
Przedstawiamy infografikę przygotowaną we współpracy z dietetykiem klinicznym z Zespołu ds. Leczenia Żywieniowego w Szpitalu Zdrowie w Kwidzynie mgr Natalią Mogiłko, która pomoże przygotować upominek dla chorego.
Powyższe zalecenia są ogólną wskazówką, jednak ostateczny wybór produktów powinien być dostosowany do stanu zdrowia chorego. Przed przyniesieniem czegokolwiek choremu należy skonsultować to z dietetykiem lub lekarzem opiekującym się pacjentem.
W przypadku pacjentów z np. wysokim poziomem potasu – sok pomidorowy nie będzie wskazany, w przypadku chorych z dysfagią – orzechy, jak i owoce także są przeciwskazane.
Rozwiązaniem w tej sytuacji może okazać dostępna w aptekach żywność specjalnego przeznaczenia medycznego, gdyż można ją stosować w większości schorzeń. Dostarczają one wysoką ilość białka i energii, które wspomagają proces regeneracyjny. Wśród takich produktów jest Nutramil Complex, Nutramil Complex Protein i Immuven.

Immuven
Kompozycja niezbędnych składników pokarmowych – białek, węglowodanów, tłuszczów, witamin, mikro- i makroelementów, a także kwasy omega-3, L-arginina i beta-1,3/1,6 glukan niezbędnych w okresie okołooperacyjnym.
Niezawodny partner prehabilitacji.
Jak odżywiać mikrobiotę jelitową?
Jak odżywiać mikrobiotę jelitową?
Mikrobiota jest bardzo istotna w każdym organizmie, dlatego powinniśmy o nią wyjątkowo dbać – nie narażać ją na zbyt duży wysiłek metaboliczny. Czym jest mikrobiota jelitowa i jak ją odpowiednio ożywiać?
Czym jest mikrobiota jelitowa?
Mikrobiota jelitowa to zbiór mikroorganizmów – ogół bakterii tlenowych i beztlenowych, obecnych właśnie w jelitach. To bardzo bogaty ekosystem, który oddziałuje na stan organizmu. W mikrobiocie jelitowej znajdują się 3 rodzaje mikroorganizmów:
- pożyteczne,
- chorobotwórcze,
- oportunistyczne.
Te trzy typy występują w stanie równowagi jedynie w zdrowym organizmie i tylko w takich okolicznościach mikrobiota może odpowiednio spełniać swoje funkcje.
Funkcje mikrobioty jelitowej
Mikrobiota jelitowa pełni ona ważne funkcje, dlatego jest ona niezwykle istotna dla utrzymania zdrowia. Jedną z kluczowych funkcji jest metabolizowanie substancji z pożywienia. Mowa tu o węglowodanach, białkach, tłuszczach oraz tych pochodzących bezpośrednio z organizmu człowieka czyli obumarłe komórki i śluz. Aby móc metabolizować potrzebuje do tego źródła energii i składników budulcowych.
Podczas metabolizacji powstaje m.in. kwas mlekowy, który może oddziaływać pozytywnie na układ odpornościowy. Oprócz wspomagania procesu trawienia dzięki mimkrobiocie wytwarzane są również witamina K, a także witaminy z grupy B. Zapobiega kolonizacji jelita przez bakterie chorbotwórcze, wycisza procesy zapalne jelit, zwiększa wchłanianie składników mineralnych i wiele więcej. Jednak aby taka sytuacja miała miejsca mikrobiota musi być dobrze odżywiana.
Odżywianie mikrobioty jelitowej
Odżywianie mikrobioty jelitowe powinno być przede wszystkim jakościowe i ilościowe, zważając na komfort spożywania posiłków. Co to oznacza? Opowie o tym prof. dr hab. n. med. Tomasz Banasiewicz.
Białko niszczy mikrobiotę?
Niestrawione białko i aminokwasy są fermentowane do różnych metabolitów, które mogą wywierać pozytywny ale również negatywny wpływ na zdrowie organizmu. Proces ten jest w znacznym stopniu uzależniony od ich stężenia w jelitach, potencjału działania i wielu innych czynników, do których można zaliczyć np. rodzaj białka, czy ilość węglowodanów w diecie.
Czy białko niszczy mikrobiotę jelitową przeczytasz klikając tutaj.

Nutramil Complex Protein
Preparat wysokobiałkowy do stosowania przy niedożywieniu, w chorobie nowotworowej, w okresie okołooperacyjnym, w czasie rekonwalescencji oraz w chorobach układu pokarmowego.
Poradnik Żywieniowy cz.2
Wypełnij formularz i odbierz ebooka

Olimp Labs
Poradnik Żywieniowy
Odżywianie chorych jest bardzo ważną składową postępowania terapeutycznego i powinno być dostosowane do indywidualnych potrzeb i stanu pacjenta.
Wykazano, iż nieprawidłowe nawyki żywieniowe oraz niewłaściwie zbilansowana dieta chorego mogą powodować:
- trudności w gojeniu się ran (np.: pooperacyjnych);
- pogorszenie skuteczności farmakoterapii;
- wydłużenie czasu hospitalizacji pacjenta;
- zwiększenie ryzyka rozwoju powikłań pochorobowych takich jak np.: zakażenia układu moczowego, czy zapalenie płuc.
W e-booku „Poradnik Żywieniowy” znajduje się szereg dobrych rad, wskazówek, które pomogą obrać odpowiedni kierunek żywieniowy, który pomoże pacjentowi zminimalizować ewentualne negatywne rezultaty leczenia. W poradniku zawarte są również przykładowe posiłki, jakie można przygotować, by zadbać o odpowiednie odżywienie.
Leczenie żywieniowe, w każdym przypadku powinno być integralną częścią terapii prowadzonej w celu poprawy stanu odżywienia pacjenta.

Nutramil Complex
Nutramil® Complex zawiera m.in. białko w postaci
kazeinianu wapnia, który charakteryzuje się krótkim
czasem wchłaniania, działa przez długi czas i pozwala na poprawę stanu odżywienia białkowego.
Może być stosowany jako jedyne źródło pożywienia.
Poradnik Żywieniowy
Wypełnij formularz i odbierz ebooka

Olimp Labs
Poradnik Żywieniowy
Niedożywienie występuje najczęściej u pacjentów w wieku podeszłym (50%), pacjentów z chorobami układu oddechowego (45%), chorobami zapalnymi jelit (80%) i nowotworami złośliwymi (85%). Wykazano również, że u 30% chorych prawidłowo odżywionych niedożywienie rozwija się po przyjęciu do szpitala, a u 70% niedożywionych w momencie przyjęcia ulega ono dalszemu pogłębieniu w trakcie hospitalizacji.
W e-booku „Poradnik Żywieniowy” znajduje się cały szereg dobrych rad, wskazówek, które pomogą obrać odpowiedni kierunek żywieniowy zarówno dla osób zmagających się z niedożywieniem, zagrożonych jego wystąpieniem, a także dla opiekunów osób chorych. Bez żywienia nie ma leczenia, o czym przekonacie się po przeczytaniu poradnika.
Wczesne rozpoznanie niedożywienia oraz szybka interwencja żywieniowa są skuteczną metodą, aby uchronić pacjenta od ciężkiego niedożywienia i powikłań z nim związanych.

Nutramil Complex
Wyjątkowa kompozycja białka, tłuszczu, węglowodanów, witamin i składników mineralnych, które dostarczają organizmowi wszystkich niezbędnych składników odżywczych w odpowiednich proporcjach zapobiegając powstania niedożywienia a także zwalczając go.
Poradnik Prehabilitacja
Wypełnij formularz i odbierz ebooka

Olimp Labs
Poradnik PREHABILITACJA
Proces leczenia, w tym operacyjnego powinien przebiegać maksymalnie sprawnie, żeby osiągnąć jak najlepszy efekt bez powikłań, bez przedłużonych hospitalizacji oraz ponownych przyjęć. Dlatego do wszelkich zabiegów, operacji i procesu leczenia należy się odpowiednio przygotować. Czas przygotowania organizmu do procesu leczenia nazywamy Prehabilitacją.
W e-booku „Poradnik Prehabilitacja” znajduje się cały szereg dobrych rad, wskazówek przygotowanych przez wybitych specjalistów: Kierownik Kliniki Chirurgii Ogólnej, Endokrynologicznej i Onkologii Gastroenterologicznej, Dyrektor Instytutu Chirurgii Uniwersytetu Medycznego im. K. Marcinkowskiego w Poznaniu prof. dr hab. n. med. Tomasz Banasiewicz, dietetyk mgr Maria Brzegowy, fizjoterapeuta mgr Aneta Sowa, psycholog Wioletta Nowak.
„Prehabilitacja to fenomen, opłaca się w zasadzie wszystkim, w aspekcie wymiernym finansowo i niewymiernym, bo jak mierzyć radość ze zdrowia. Mimo to wciąż jeszcze zbyt rzadko staje się faktem. (…) Czy jednak wszędzie? A jeśli nie to dlaczego”
prof. dr hab. n. med. Tomasz Banasiewicz
Immuven
Kompozycja niezbędnych składników pokarmowych – białek, węglowodanów, tłuszczów, witamin, mikro- i makroelementów, a także kwasy omega-3, L-arginina i beta-1,3/1,6 glukan niezbędnych w okresie okołooperacyjnym.
Niezawodny partner prehabilitacji.
Kto jest najbardziej narażony na powstawanie ran przewlekłych?
Kto jest najbardziej narażony na powstawanie ran przewlekłych?
Rany przewlekłe to trudno gojące się rany, które bez specjalistycznego leczenia nie są w stanie się zabliźnić.
Mogą mieć rozmaitą etiologię, najczęściej stanowią powikłanie przewlekłej niewydolności żylnej, cukrzycy, długiego unieruchomienia, przewlekłej niewydolności tętniczej, chorób układu limfatycznego, zaburzeń metabolicznych, hematologicznych, nowotworowych, a także powikłań pooperacyjnych.
Kto jest narażony na powstawanie ran przewlekłych?
W grupie największego ryzyka powstawania ran przewlekłych znajdują się przede wszystkim seniorzy. Jednak należy pamiętać, że na ich wystąpienie mają wpływ choroby współistniejące, dlatego również u osób młodych mogą wystąpić rany przewlekłe. Posłuchaj co na ten temat ma do powiedzenia mgr Zuzanna Konrady – pielęgniarka, specjalistka w leczeniu ran.
L-arginina w procesie gojenia ran
Wykazano, że produkty szlaków l-argininy: mocznik, prolina, poliaminy oraz tlenek azotu wpływają na różne fazy gojenia się rany. Tlenek azotu wpływa również stymulująco na układ immunologiczny i bierze udział w procesach bakteriobójczych. Ponadto tlenek azotu działa rozszerzająco na naczynia krwionośne, co jest szczególnie ważne w przypadku stopy cukrzycowej.
Wewnątrz rany ilość l-argininy może zmniejszyć się do niewykrywalnego stężenia i w takim przypadku jej dostępność jest niezbędna do tego, żeby rana się zagoiła.
L-arginina bierze udział w syntezie kolagenu, głównego białka, budulca tkanek łącznych, takich jak skóra i tkanki łączne.
Aby zapewnić organizmowi odpowiednią podaż l-argniny i innych niezbędnych do gojenia się ran składników zaleca się stosowanie żywności specjalnego przeznaczenia medycznego – Arginilan.

Arginilan
Innowacyjna formuła zawierająca wysoką porcję l-argininy, hydrolizatu kolagenu, a także wysoce przyswajalny cynk w postaci chelatu aminokwasowego Albion oraz witaminy A i C.
Kacheksja nowotworowa – czym jest i jak leczyć?
Kacheksja nowotworowa – czym jest i jak leczyć?
Kacheksja to wyniszczenie organizmu, któremu towarzyszy znaczny spadek masy mięśniowej. Powstaje na skutek ciężkiej, przewlekłej choroby, schorzenia zakaźnego, a nawet uzależnienia. Najczęściej jest to jednak kacheksja nowotworowa (zwana również zespołem CAC), która jest następstwem zaawansowanego stadium rozwoju nowotworu.
Kacheksję nowotworową definiuje się jako zespół zaburzeń z długotrwałą utratą beztłuszczowej masy ciała, gdzie organizm nie reaguje na leczenie żywieniowe i z dnia na dzień stan sprawności pacjenta się pogarsza.
W trakcie choroby nowotworowej organizm zmaga się z wieloma zmianami i wiele codziennych procesów organizmu jest utrudnionych. Do najważniejszych przyczyn wystąpienia kacheksji nowotworowej należą:
- zaburzenia odżywiania na skutek spadku łaknienia, czy też przeszkody w postaci np. guza na przełyku;
- nasilenie procesów metabolicznych oraz katabolicznych;
- niewystarczający stan składników odżywczych (których w chorobie nowotworowej potrzebne jest znacznie więcej, niż u osoby zdrowej, by organizm mógł sprostać procesom metabolicznym);
- niepożądane działanie leczenia nowotworu;
- nasilenie reakcji zapalnych.
Objawy i rozpoznanie kacheksji nowotworowej
Pierwszym z objawów kacheksji nowotworowej jest jadłowstręt o różnym tempie rozwoju i stopniu nasilenia. Pacjenci zatracają zmysł smaku i węchu, następnie spożywają mniejsze porcje posiłków, szybciej odczuwają nasycenie, a także mdłości, aż niekiedy całkowicie odmawiają jedzenia. W odróżnieniu od anoreksji, w kacheksji nowotworowej mechanizmem wywołującym spadek masy ciała nie są zaburzenia psychiczne, a zmiany nowotworowe w organizmie.
Na Europan Association for Palliative Care (EAPC) ustalone zostały ramy, które pozwalają stwierdzić wystąpienie kacheksji nowotworowej. Wystąpienie jednego z 3 poniższych scenariuszy wskazuje na wystąpienie schorzenia:
- utrata masy ciała więcej niż 5% (bądź równa 5%) w ciągu 6 miesięcy;
- utrata masy ciała więcej niż 2% w ciągu 6 miesięcy, jeśli wskaźnik BMI jest mniejszy niż 20 kg/m2;
- utrata masy ciała więcej niż 2% wraz z obniżeniem ALM (appendicular lean mass index).
Proces leczenia onkologicznego (radioterapia, chemioterapia, chirurgia) bardzo często prowadzi do utarty masy ciała. Jeśli jednak tej tracie towarzyszą zaburzenia węchu i smaku, czy astenia, należy wziąć pod uwagę możliwość wystąpienia kacheksji nowotworowej.
Konsekwencje kacheksji w chorobie nowotworowej
Wystąpienie kacheksji w procesie leczenie nowotworowego niesie ze sobą wiele negatywnych oddziaływań na cały ten proces. Kacheksja może prowadzić do:
- zmniejszenia masy ciała,
- osłabienia siły mięśniowej,
- osłabienia odporności,
- osłabienia perystaltyki jelit,
- zaburzeń krzepnięcia krwi.
Wszystkie te sytuacje prowadzą do pogorszenia odpowiedzi organizmu na proces leczenia onkologicznego, zwiększa się ryzyko wystąpienia powikłań, a co za tym idzie wydłużenie hospitalizacji, wzrost kosztów leczenia, wzrost infekcji, lęk, depresję, aż ostatecznie może doprowadzić do zaniechania leczenia. Dlatego tak istotne jest odpowiednie przygotowanie organizmu do procesu leczenia.
Leczenie kacheksji nowotworowej
Leczenie kacheksji nowotworowej jest trudne. Ciężko, aby tak wyniszczony organizm wrócił do formy sprzed choroby, ale skuteczna interwencja jest jak najbardziej możliwa, dzięki czemu jest szansa na zmniejszenie powikłań procesu walki z nowotworem.
Przede wszystkim należy zadbać o odpowiednie odżywienie pacjenta, które należy rozpocząć od oceny stanu odżywienia (skala NRS 2002 i SGA) i przygotowanie indywidualnych zaleceń. Podaż białka u dorosłego człowieka z chorobą nowotworową powinna wynosić 1,2–2,0 g/kg mc./dobę, a podaż energii 25–30 kcal/kg mc./dobę. W przypadku pacjenta niedożywionego zapotrzebowanie to wzrasta niemal dwukrotnie, a przeliczeń powinno się dokonywać na aktualną masę ciała, zaś w przypadku pacjentów otyłych – na idealną masę ciała.
Żywienie powinno być kompletne, nawet u osób otyłych należy dbać o to, by posiłki były odpowiedniej wielkości, ale przede wszystkim jakości. Produktem wysokobiałkowym i energetycznym zalecanym w procesie leczenia jest Nutramil Complex Protein.
Ważnym aspektem jest również wdrożenie aktywności fizycznej, która pozwoli na powrót procesów anabolicznych w mięśniach. Nawet kilka ćwiczeń dziennie może zmniejszyć kataboliczny wpływ kacheksji i nasilenie stanu zapalnego. Jak odpowiednio przygotować się do procesu leczenia, by zapewnić organizmowi, jak najlepsze warunki do walki z chorobą znajdują się w Poradniku Prehabilitacja, który możesz pobrać za darmo z naszej strony.
Autor: zespół Olimp Labs
Literatura:
1. Fearon K, Strasser F, Anker SD, et al. Definition and classification of cancer cachexia: an international consensus. Lancet Oncol. 2011; 12(5): 489–495, doi: 10.1016/S1470-2045(10)70218-7, indexed in Pubmed: 21296615.
2. Grabiec K, Burchert M, Milewska M, et al. Systemic and local mechanisms leading to cachexia in cancer. Postępy Higieny i Medycyny Doświadczalnej. 2013; 67: 1397–1409, doi: 10.5604/17322693.1085135.
3. Krzemieniecki K. Leczenie wyniszczenia nowotworowego — dobrodziejstwo dla chorych a przekleństwo dla NFZ? Krytyczna analiza zjawiska terapii wyniszczenia nowotworowego w Polsce. Współczesna Onkologia. 2008; 12(1): 38–42.

Nutramil Complex Protein
Produkt przeznaczony dla pacjentów onkologicznych oraz chorych, którzy nie są w stanie dostarczyć wraz z dietą wszystkich składników odżywczych organizmowi.
Dlaczego warto żywić pacjenta z chorobą nowotworową?
Dlaczego warto żywić pacjenta z chorobą nowotworową?
Odpowiednio zbilansowana dieta dostarcza do organizmu niezbędnych składników odżywczych (m.in. węglowodanów, tłuszczów, białka, witamin, składników mineralnych). Dzięki temu organizm człowieka ma siłę do przeprowadzenia wszystkich procesów w odpowiedni sposób.
Odpowiednia podaż składników odżywczych ma jeszcze większe znaczenie w przypadku chorowania na nowotwór. U chorego ulegają zmianie potrzeby żywieniowe oraz możliwości przyjmowania posiłków, oraz przyswajania składników odżywczych.
Żywienie w chorobie nowotworowej jest istotne?
Posłuchaj wypowiedzi prof. dr hab. n. med. Stanisława Kłęka.
Rola białka w chorobie nowotworowej
W diecie osoby chorej na nowotwór niezwykle istotne jest białko, pełniące funkcję regulacyjną procesów życiowych, utrzymanie równowagi ciała i przede wszystkim odpowiada za wzrost i odbudowę (np. przy procesie gojenia ran).
Średnie zapotrzebowanie na białko u zdrowego człowieka wynosi ok. 0,8 g na każdy kilogram masy ciała na dobę. Chory na nowotwór potrzebuje ich natomiast niemalże dwukrotnie więcej (ok. 100 g dziennie). Według wytycznych ESPEN rekomenduje się podaż białka na poziomie najlepiej wyższym niż 1,5 g, do 2 g/kg m.c. w ciągu doby.
Więcej na ten temat przeczytasz na blogu Rola białka w chorobie nowotworowej.

Nutramil Complex Protein
Preparat wysokoenergetyczny w postaci granulatu, który w wygodny sposób można podawać zarówno po rozpuszczeniu w wodzie, jak i po dodaniu do ulubionych potraw. Dostarcza organizmowi 18,8 g białka w jednej porcji.
Zasady żywienia po resekcji żołądka
Zasady żywienia po resekcji żołądka
Zasady żywienia po resekcji żołądka (inaczej gastrektomii) można porównać do rozszerzania diety u niemowląt. Pacjentowi rekomenduje się ostrożne wprowadzanie niewielkich ilości poszczególnych pokarmów, uważnie obserwując swoją tolerancję. Sprawne rozszerzanie jadłospisu będzie stanowić prewencję rozwoju niebezpiecznego niedożywienia, które w tej grupie chorych jest niestety dosyć częstym zjawiskiem.
Pierwsze dni po operacji
W zależności od ośrodka, poszczególne etapy rozszerzania diety po operacji mogą trwać od kilku dni do nawet kilku tygodni. W tym czasie, chory stopniowo testuje poszczególne pokarmy, powoli zmieniając ich konsystencję – zaczynając od dań płynnych, następnie sięgając po półpłynne, papkowate, aż wreszcie po stałe. Jeśli pacjent nie otrzymał ze szpitala szczegółowych wytycznych, dla własnego komfortu i poczucia bezpieczeństwa, może posłużyć się poniższym schematem:
Dieta płynna obowiązuje w trakcie hospitalizacji (a czasami również i przez pewien czas po jej zakończeniu). Po uzyskaniu zgody lekarza prowadzącego, pacjent może zacząć popijać wodę, słabą herbatę, czyste zupy na chudym wywarze oraz zupy mleczne (zwykle na mleku bez laktozy). Szpitale stosujące się do tzw. protokołu nowoczesnej opieki okołooperacyjnej dla poprawy wyników leczenia (ERAS, ang. Enhanced Recovery After Surgery), podają również odżywki specjalnego przeznaczenia medycznego (tj. ONS, ang. oral nutritional supplements), dostarczające pacjentowi potrzebnych kalorii oraz białka*. Odżywki przydają się też i na późniejszych etapach – po powrocie do domu oraz w trakcie ewentualnej terapii uzupełniającej. Takie postępowanie będzie istotne zwłaszcza wtedy, gdy pacjent nie jest w stanie w wystarczający sposób odżywiać się drogą doustną.
W części ośrodków, kolejne etapy zmiany konsystencji wprowadzane są już na etapie hospitalizacji. Ważnym zaleceniem w tym okresie, jest dokładne gryzienie oraz żucie każdego kęsa pokarmu. Tylko w taki sposób chory zabezpieczy się przed niepożądanymi następstwami i dolegliwościami bólowymi. Na etapie diety miksowanej/miękkiej, można sięgnąć po np. musy owocowe, twarożek z jogurtem naturalnym, puree warzywne (np. z ziemniaków, marchewki) czy delikatne klopsiki z mięsa drobiowego. Etap diety stałej obejmuje już tradycyjnie jedzone wcześniej przez pacjenta pokarmy – oczywiście zgodnie z założeniami diety łatwostrawnej i stopniowego testowania poszczególnych pokarmów.
Dieta łatwostrawna i dalsze rozszerzanie diety
Na etapie diety łatwostrawnej zaleca się wybierać produkty miękkie, o niskim udziale błonnika pokarmowego, delikatnie przyprawione. Jeśli pokarmy są twardsze, należy pamiętać o dokładnym pogryzieniu i pożuciu każdego kęsa. Wśród produktów z jakich można komponować posiłki znajdują się m.in.:
- pszenne pieczywo (np. weka, kajzerka),
- biały ryż,
- drobne makarony (np. nitki),
- kasza manna, kuskus,
- chude mięso (np. pierś z kurczaka, filet z indyka),
- chude ryby (np. dorsz, sola, mintaj).
Owoce i warzywa podaje się w formie przetworzonej, tj. ugotowane, upieczone (np. pieczone jabłko) i rozdrobnione (np. musy). Delikatne tłuszcze (masło, świeża oliwa extra vergine, olej rzepakowy) dodaje się na zimno, do gotowej już potrawy. Spośród przypraw można sięgnąć po rozsądne ilości soli, a także po koperek, pietruszkę, wanilię, cynamon oraz sok z cytryny.
Posiłki należy przygotowywać metodą gotowania we wodzie, na parze, duszenia bez obsmażania, pieczenia w rękawie, w zamkniętym naczyniu albo we folii. Smażenie, zwłaszcza w głębokim tłuszczu, w panierce, nie jest na tym etapie rozszerzania diety wskazane.
Najważniejszym zaleceniem żywieniowym jest spożywanie małych, ale częstych posiłków. Obowiązująca w założeniach zdrowego żywienia zasada jedzenia 5 dań co 3–4 godziny, nie znajduje tu żadnego uzasadnienia. Celem dostarczenia odpowiedniej liczby kalorii oraz cennego białka, chory może jeść nawet co godzinę.
W procesie rozszerzania diety, dąży się do tego, aby pacjent mógł spożywać wszystkie lubiane wcześniej produkty. Nie nastąpi to niestety od razu – adaptacja trwa zwykle od kilku tygodni do nawet kilku miesięcy. Bywa też, że niektóre pokarmy nie będą już przez chorego akceptowane tak jak dotychczas. W takiej sytuacji najlepiej skorzystać z porady dietetyka klinicznego, który zmodyfikuje ulubiony przepis.
Możliwe następstwa gastrektomii
Pacjent poddany resekcji żołądka jest narażony na wystąpienie tzw. dumping syndrome, inaczej zespołu poresekcyjnego. Zespół ten charakteryzuje się pojawieniem dolegliwości naczynioruchowych i żołądkowo-jelitowych, związanych z m.in. szybką ekspozycją jelita cienkiego na dostarczone mu w pożywieniu składniki odżywcze. U chorego mogą pojawić się m.in.: bóle brzucha, biegunka, wymioty, palpitacja serca, tachykardia, spadek ciśnienia tętniczego krwi, osłabienie, pocenie się, zaburzenia świadomości oraz/lub drgawki. Aby zmniejszyć ryzyko wystąpienia opisanej sytuacji, zaleca się m.in. unikanie jedzenia i picia produktów oraz potraw o wysokiej zawartości tłuszczu albo/i cukru, w tym słodkich napojów, nadmiaru słodyczy czy lodów.
Po usunięciu żołądka, częstą dolegliwością pacjentów może też być zmiana w zakresie rytmu wypróżnień, zwłaszcza przewlekłe biegunki. Częstą ich przyczyną są produkty mleczne, naturalnie zawierające w swoim składzie laktozę. Powodem luźniejszych stolców może być także zbyt długo prowadzona dieta płynna (bądź przewaga w jadłospisie takich posiłków), jak również nadmiar cukru i tłuszczu. Celem zmniejszenia częstotliwości luźnych wypróżnień, można zastosować elementy diety BRAT tzn.:
- B – jak banany (zielone, mało dojrzałe),
- R – jak ryż (rozgotowany, wafle ryżowe itp.),
- A – jak apple (ang. jabłko; pieczone, mus),
- T – jak tost (pieczywo suche, czerstwe, sucharki).
Działaniem zapierającym odznaczają się także: chude mięso gotowane, jajka na twardo, kluski, kopytka, galaretka z mięsem i marchewką, gorzka czekolada, gotowane jagody, chrupki kukurydziane itp.
Niedożywienie jako główny czynnik powikłań leczenia
Jak już wcześniej wspomniano, częstym problemem pacjentów po resekcji żołądka jest spadek masy ciała prowadzący do rozwoju niebezpiecznego niedożywienia. Taka sytuacja może stanowić ważny czynnik powikłań w trakcie leczenia, a ponadto może stać się powodem odstąpienia zespołu leczącego od dalszej terapii (np. odsunięcie cyklu chemioterapii). Chory po gastrektomii powinien więc pozostawać pod opieką doświadczonego dietetyka klinicznego, który poradzi co i w jaki sposób przygotowywać, aby zapobiec utracie wagi. Warto w tym miejscu ponownie podkreślić, że zasady zdrowego żywienia nie znajdują w tym obszarze chirurgii (i nie tylko w tym) uzasadnienia. Chory po gastrektomii, u którego objętość posiłku możliwa do przyjęcia jest aktualnie znacznie ograniczona, w pierwszej kolejności powinien sięgać po produkty dostarczających mu kalorii oraz białka tj. mięso, ryby, jaja, nabiał, zdrowe tłuszcze, produkty zbożowe z „jasnej” mąki, a nawet desery (z umiarem – dumping syndrome!) i słone przekąski (paluszki, krakersy itp.). Warzywa i owoce są od teraz traktowane raczej jako dodatek smakowy, aniżeli podstawowe źródło składników pokarmowych. Dobrym uzupełnieniem codziennej diety będą też odżywki medyczne typu ONS.
*dostępne jako odżywki płynne albo proszek przeznaczony do rozpuszczenia lub dodawania do posiłków
Autor: mgr Maria Brzegowy, dietetyk kliniczny
Literatura:
1. Jankowski M., Kłęk S.: Biblioteka chirurga onkologa. Terapia żywieniowa u chorych operowanych z powodu nowotworów złośliwych. Wydawnictwo Via Medica, Gdańsk 2019.
2. Kłęk S.: Leczenie żywieniowe w onkologii. Onkologia w praktyce klinicznej 2011, 7, 5, 269-273.
3. Kapała A.: Dieta w chorobie nowotworowej. Wydawnictwo Buchmann, Warszawa 2018.
4. Brzegowy M., Maciejewska-Cebulak M., Turek K.: Nie daj się rakowi! Wsparcie żywieniowe w chorobie nowotworowej. Wydawnictwo M, Kraków 2018.
5. Tokajuk A., Car H., Wojtukiewicz M.Z.: Problem niedożywienia u chorych na nowotwory. Medycyna Paliatywna w Praktyce, 2015, 9, 1, 23-29.

Immuven
Kwasy omega-3 ograniczają reakcje zapalną, l-arginina w połączeniu z innymi immunoskładnikami zmniejsza odsetek powikłań infekcyjnych oraz korzystnie wpływa na gojenie się ran.
Interwencja żywieniowa u pacjenta z trudno gojącymi się ranami
Interwencja żywieniowa u pacjenta z trudno gojącymi się ranami
Opieka nad ranami wymaga wielokierunkowej i często długotrwałej terapii, w trakcie której należy uwzględnić wiele czynników, mających wpływ na prawidłowe wygojenie rany. Odpowiednie jej oczyszczenie, kontrola infekcji i procesu zapalenia, utrzymywanie równowagi wilgotności rany i obserwacja jej brzegów, jak również stymulacja procesu naskórkowania, to dobrze znane elementy postępowania z raną w strategii TIME, czyli stosowanych w środowisku medycznym zasad opieki nad raną, zaproponowanych przez European Wound Management Association1.
Powszechnie wiadomo, że trudno gojące się rany są olbrzymim utrapieniem dla pacjentów i ich opiekunów, wiążą się z wieloma powikłaniami, przez co są sporym obciążeniem dla systemu zdrowotnego. Szacuje się, że koszty leczenia ran stanowią około 3% całkowitych kosztów systemu opieki zdrowotnej. Z uwagi na ich powszechność, rany nazywane są nawet cichą epidemią (ang. „The silent epidemic”), dlatego tak ważna jest właściwa opieka nad nimi2.
W leczeniu ran przede wszystkim nie można zapominać o ważnych składnikach odżywczych i odpowiednim stanie odżywienia pacjenta, gdyż to właśnie te czynniki warunkują prawidłowe gojenie rany. Ponad to, substancje dodatkowe, w które wzbogacana jest dieta pacjenta, mogą znacząco przyspieszyć proces gojenia.
Proces gojenia rany a stan odżywienia
Proces gojenia rany jest niezwykle złożony i zazwyczaj można go podzielić na trzy fazy:
- Zapalną – trwająca do 6 dni od urazu, w trakcie którego w miejscu zranienia tworzy się skrzep fibrynowy, zwiększa się przepuszczalność naczyń i dochodzi do wysięku, w obszarze rany pojawiają się neutrofile i makrofagi, które neutralizują bakterie;
- Proliferacyjną – rozpoczynająca się 3-5 dni od urazu i trwająca nawet do 3 tygodni, a w jej trakcie dochodzi do proliferacji fibroblastów, angiogenezy i sieciowania kolagenu oraz skurczu rany;
- Przebudowy (remodelingu), która rozpoczyna się około 2 tygodnie po urazie i może trwać nawet do 2 lat, podczas których następuje dojrzewanie i stabilizacja kolagenu, wzrasta jego wytrzymałość na rozciąganie i dochodzi do tworzenia blizn3.
Każda z tych faz gojenia regulowana jest na poziomie humoralnym i komórkowym, a niedożywienie jest czynnikiem silnie zaburzającym te procesy.
Niedostateczna podaż składników odżywczych zaburza pracę układu odpornościowego, zaburza syntezę kolagenu, może zmienić wytrzymałość na rozciąganie tkanek, a każdy z tych procesów jest niezbędny podczas gojenia4. Może dochodzić również zaburzenia procesu powstawania naczyń krwionośnych w tkance, a także do wydłużenia fazy zapalnej procesu gojenia5.
Interwencja żywieniowa u chorych z trudno gojącymi się ranami
Pacjenci niedożywieni narażeni są na spowolnienie procesów gojenia rany, infekcje i powstawanie ran przewlekłych, dlatego też każdy pacjent, przygotowywany do zabiegu operacyjnego, zagrożony powstaniem odleżyn lub pacjent z raną urazową powinien zostać poddany ocenie stanu odżywienia6. Jeśli u pacjenta zostanie zdiagnozowane niedożywienie, to powinien on zostać poddany poszerzonej ocenie stanu odżywienia (wykonywanej przez lekarza lub dietetyka), a następnie, zgodnie z jej wynikiem powinna zostać przeprowadzona odpowiednia interwencja żywieniowa. Kolejność jej wdrażania jest następująca (ryc.1):
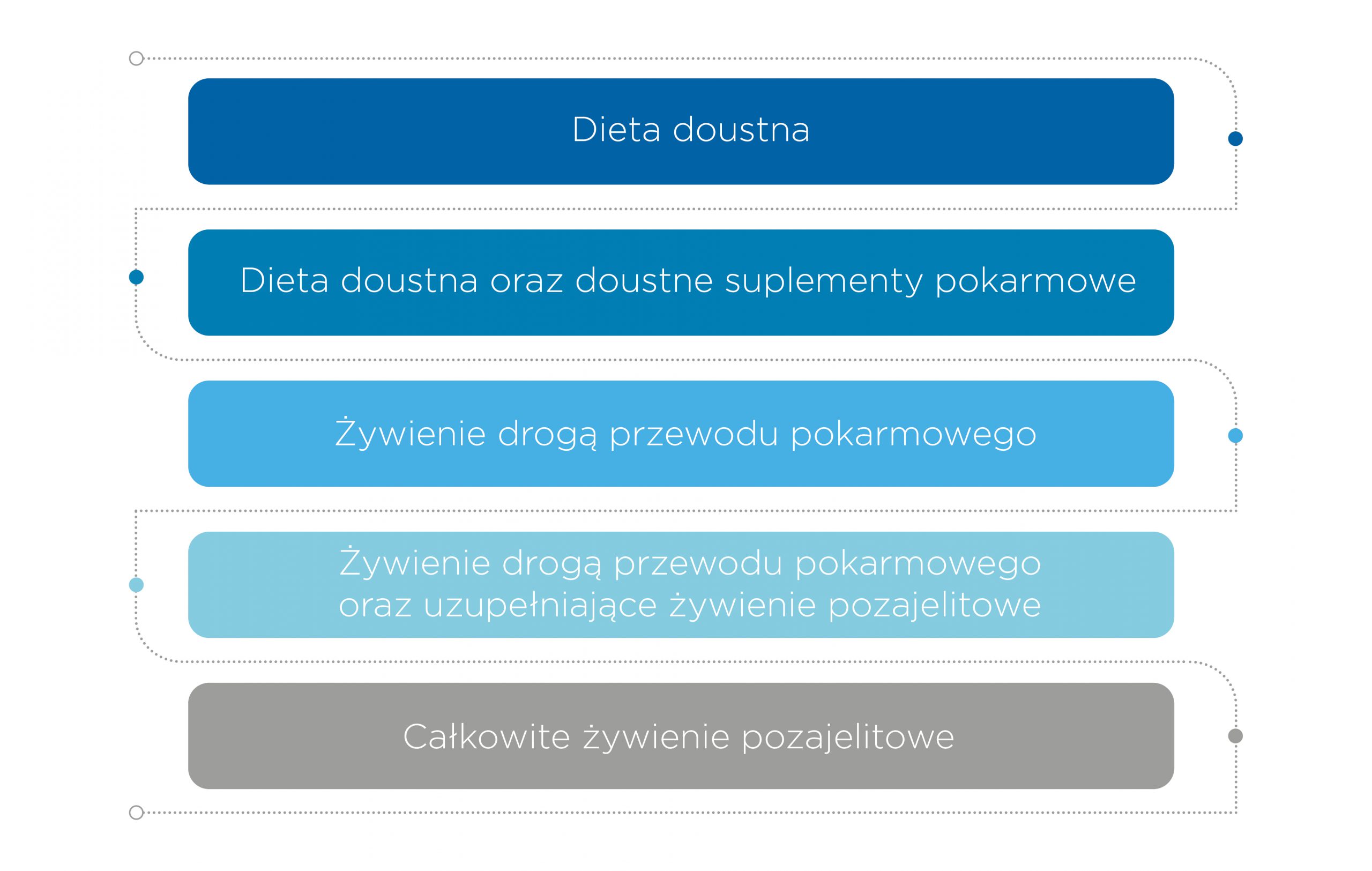
Rycina 1. Kolejność wdrażania interwencji żywieniowej u pacjenta
Udowodniono, że pacjenci niedożywieni mają zwiększone ryzyko rozejścia się zespolenia, wykonanego w trakcie operacji, a w przypadku pacjentów długotrwale unieruchomionych istnieje zwiększone ryzyko rozwoju odleżyn7.
Żywienie pacjenta powinno pokrywać dzienne zapotrzebowanie kaloryczne na poziomie 25-30 kcal/kg masy ciała na dobę oraz podaż białka w ilości 1-1,2g/kg masy ciała na dobę. W przypadku pacjentów z już istniejącym niedożywieniem lub pacjenta z trudno gojącymi się ranami dzienne zapotrzebowanie kaloryczne wzrasta do 30-35 kcal/ kg masy ciała na dobę oraz 1,2-1,5 g białka na kilogram masy ciała na dobę5.
Jeśli to tylko możliwe, pacjent powinien odżywiać się drogą doustną pod kontrolą dietetyka, który będzie kontrolować jego dziennie spożycie pokarmów. W przypadku zmniejszenia przyjmowania składników odżywczych, gdy zachowana jest możliwość odżywiania się drogą przewodu pokarmowego, w pierwszej kolejności należy dołączyć tzw. doustne suplementy pokarmowe, podawane pomiędzy głównymi posiłkami. Ich zaletą jest skoncentrowana ilość składników odżywczych w małej objętości, a także możliwość wyboru preparatów, które wzbogacane są o dodatkowe substancje, które mają udowodnioną skuteczność w procesie gojenia rany.
W przypadku, gdy pacjent nie będzie przyjmować wystarczającej ilości składników drogą doustną (brak jest możliwości utrzymania dziennego spożycia pokarmów w ilości pokrywającej minimum 60% zalecanej normy przez 10 dni) należy rozważyć żywienie drogą przewodu pokarmowego (z wykorzystaniem sztucznych dostępów). Jeśli nie będzie możliwości zapewnienia odpowiedniej ilości składników odżywczych drogą przewodu pokarmowego to kolejną i ostateczną możliwością żywienia pacjenta jest żywienie pozajelitowe – drogą żył obwodowych lub centralnych.
Rola poszczególnych składników odżywczych w gojeniu ran
Dieta pacjenta, u którego dochodzi do procesu gojenia rany, powinna być zróżnicowana i powinna ona zapewniać wszystkich makro- i mikroskładników. Dodatkowo, wzbogacanie diety w wybrane substancje może przyspieszyć poszczególne etapy gojenia i w konsekwencji ułatwić wygojenie się rany. Najważniejszymi z nich jest:
Białko
Jest podstawowym składnikiem budulcowym, niezbędnym w procesie gojenia ran. Aminokwasy są niezbędne w zasadzie na każdym etapie gojenia rany – podczas procesu syntezy kolagenu, angiogenezy, proliferacji fibroblastów, przebudowy tkanek (stabilizacja powstającej blizny) oraz właściwego funkcjonowania komórek układu odpornościowego8. Odpowiednia podaż białka w diecie pacjenta jest konieczna, aby zapobiec degradacji własnych białek i wyniszczeniu. Ustalając dobowe zapotrzebowanie na proteiny należy brać pod uwagę również potencjalną utratę białka wraz z wysiękiem, szczególnie w przypadku pacjentów z ranami o dużej powierzchni i ranami oparzeniowymi. Dzienna podaż białka powinna wynosić nawet do 1,5g/kg masy ciała na dobę5.
Arginina
Jest to obecnie jeden z najlepiej przebadanych składników immunożywienia. Jest aminokwasem o udowodnionym działaniu w procesie gojenia ran gdyż odgrywa ona ważną rolę w przemianach azotu w organizmie. W warunkach stresu metabolicznego, jakim jest uraz, sepsa, oraz występowanie trudno gojących się ran, potrzeby organizmu przewyższają endogenną produkcję argininy i staje się ona aminokwasem deficytowym5. Jednym z najważniejszych szlaków metabolicznych argininy jest reakcja jej dezaminacji, katalizowanej przez syntazę tlenku azotu (NOS), która prowadzi do powstania tlenku azotu (NO). Jest to proces znacząco nasilony podczas fazy zapalnej i proliferacyjnej gojenia rany, a jego bezpośrednim następstwem jest wzrost zawartości tlenku azotu w zranionej tkance oraz wzrost przepływu krwi, co umożliwia dostarczenie optymalnej ilości składników odżywczych do regenerujących się tkanek. Dodatkowo tlenek azotu bierze również udział w syntezie kolagenu9. Sama arginina, jako prekursor proliny, jest również niezbędna w tym procesie, dlatego jej suplementacja u pacjentów z ranami jest szczególnie korzystna10,11. Znaczenie zwiększonej podaży argininy, jako czynnika zmniejszającego ryzyko powikłań okołooperacyjnych w gojeniu ran, zostało docenione przez grono ekspertów opracowujących zalecenia żywieniowe dla pacjentów chirurgicznych. W wytycznych Europejskiego Towarzystwa Żywienia Klinicznego i Metabolizmu doustne preparaty z argininą, kwasami omega-3 i nukleotydami są dedykowane pacjentom w okresie okołooperacyjnym12.
Glutamina
Jest to kolejny aminokwas niezbędny dla szybko dzielących się komórek organizmu, takich jak enterocyty czy limfocyty. Odpowiada ona za utrzymanie integralności bariery jelitowej oraz poprawę odporności chorego. W warunkach stresu metabolicznego jej znaczenie wzrasta, a rola jej suplementacji u pacjentów krytycznie chorych jest obecnie niepodważalna. Korzyści z tego rodzaju suplementacji mogą odnieść również pacjenci z oparzeniami, gdyż ich rezerwy glutaminy bardzo szybko się wyczerpują. Udowodniono skuteczność suplementacji glutaminą w gojeniu ran u chorych oparzonych (dieta dojelitowa, wzbogacona glutaminą, powodowała zmniejszenie powikłań infekcyjnych, powodowała skrócenie gojenia ran oraz czasu hospitalizacji), operowanych w obrębie głowy i szyi (szybsze gojenie ran i mniej powikłań infekcyjnych u chorych otrzymujących wysokobiałkową dietę z glutaminą) oraz chorych ze stopą cukrzycową (szybsze gojenie ran u chorych przyjmujących doustnie preparaty z argininą, glutaminą i hydroksymaślanem)13,14,15.
Podobne efekty działania argininy i glutaminy wynikają z pokrywania się ich szlaków metabolicznych. Glutamina metabolizowana jest bowiem do argininy i dzięki temu pośrednio staje się substratem dla syntezy tlenku azotu. Glutamina jest ponadto prekursorem glutationu, dzięki czemu chroni komórki przed uszkodzeniami oksydacyjnymi. Bierze też udział w syntezie kolagenu oraz innych białek komórki, co daje podstawę prawidłowej odnowy tkanek. Stanowi również ważny mediator odpowiedzi zapalnej, gdyż zwiększa aktywację i proliferację makrofagów i limfocytów5.
Cynk
Jest niezbędny do prawidłowego wzrostu i metabolizmu kości oraz funkcjonowania ośrodkowego układu nerwowego oraz układu immunologicznego. Jako kofaktor wielu reakcji enzymatycznych zaangażowany jest w procesy biosyntezy kwasów nukleinowych i białek5. Pierwiastek ten stanowi składnik około 200 enzymów, z których wiele zaangażowanych w proces gojenia ran. Jednym z nich jest dysmutaza ponadtlenkowa, która stanowi jeden z elementów bariery antyoksydacyjnej organizmu16. W procesie gojenia ran obecność cynku jest konieczna na każdym z etapów tego procesu. Bierze on udział w procesie hemostazy, kiedy to jest niezbędny do agregacji płytek krwi a w trakcie stanu zapalnego ogranicza poziom cytokin prozapalnych oraz zmniejsza stres oksydacyjny w tkance. Cynk jest również dla właściwej aktywności neutrofilii i fagocytów, biorących udział w obronie tkanek przed patogenami10.
Selen
Jest pierwiastkiem śladowym, który również ma silne działanie antyoksydacyjne. Stanowi jedną z pierwszych linii obrony komórek organizmu przed wolnymi rodnikami tlenowymi jako składnik peroksydazy glutationowej. W jednym z badań udowodniono, że jego dożylna suplementacja wraz z cynkiem i miedzią u pacjentów z oparzeniami skutkowała zmniejszoną ilością infekcji oraz poprawą gojenia ran, jak również lepszym statusem antyoksydacyjnym osocza i tkanek, w porównaniu z grupą pacjentów bez dodatkowej suplementacji17. Dowodzi to, że suplementacja pierwiastków śladowych, takich jak cynk i selen, jest korzystna dla pacjentów borykających się z trudno gojącymi się ranami.
Witamina A
Suplementowana u pacjentów z gojącymi się ranami, ma zdolność pobudzania odnowy tkanek – stymuluje wzrost komórek, pobudza proces angiogenezy w trakcie odbudowy tkanek oraz bierze udział w procesie syntezy kolagenu [18]. Zwiększa także odpowiedź immunologiczną w trakcie fazy zapalnej, promując proces agregacji monocytów i makrofagów w obszarze rany7.
Witamina C
Bierze udział w syntezie kolagenu, a jej niedobory skutkują, jak wiadomo od setek lat, pojawieniem się objawów szkorbutu. Jako koenzym hydroksylazy prolinowej i lizynowej bierze bowiem udział w syntezie kolagenu – jest niezbędna do prawidłowego przekształcenia prokolagenu w kolagen19. Ponadto, witamina C jest niezbędna do właściwego funkcjonowania neutrofili czy monocytów, zaangażowanych podczas fazy zapalenia i proliferacji gojenia rany. Neutrofile pod wpływem witaminy C wykazują się wyższą zdolnością do fagocytozy i neutralizacji mikroorganizmów, co następnie indukuje apoptozę i oczyszczanie rany za pomocą makrofagów. Witamina C powoduje również zmniejszenie produkcji mediatorów prozapalnych oraz wzrost produkcji mediatorów stymulujących gojenie się rany. Kwas askorbinowy promuje również migrację fibroblastów podczas gojenia tkanki łącznej20. Ponad to, jako silny przeciwutleniacz witamina C chroni składniki komórki takie jak białka, kwasy nukleinowe i tłuszcze przed wolnymi rodnikami. W przypadku chorego z trudno gojącą się raną podaż tej witaminy będzie korzystna podczas fazy zapalenia, jak również w późniejszych fazach, gdy intensyfikacji ulega proces produkcji kolagenu. U pacjentów zalecana jest dodatkowa suplementacja witaminą C w dawce 500-1000mg dziennie a jeśli są to rany ciężkie, np. u chorych z dużą powierzchnią oparzenia, to dawki te powinny wynosić nawet 1000-2000mg21,22.
Korzystnym skutkiem utrzymywania odpowiedniego stanu odżywienia oraz wzbogacania diet pacjentów leczonych żywieniowo w wybrane składniki będzie skrócenie czasu gojenia ran, zmniejszenie ilości powikłań związanych z tym procesem oraz skrócenie czasu hospitalizacji czy rekonwalescencji oraz kosztów z tym związanych. Planując każdą procedurę, w tym leczenie ran należy pamiętać o ocenie stanu odżywienia pacjenta i odpowiedniej suplementacji diety pacjenta, gdyż to właśnie ta najprostsza, a często niedoceniana i pomijana procedura może dać najbardziej wymierne efekty w trakcie rekonwalescencji pacjenta.
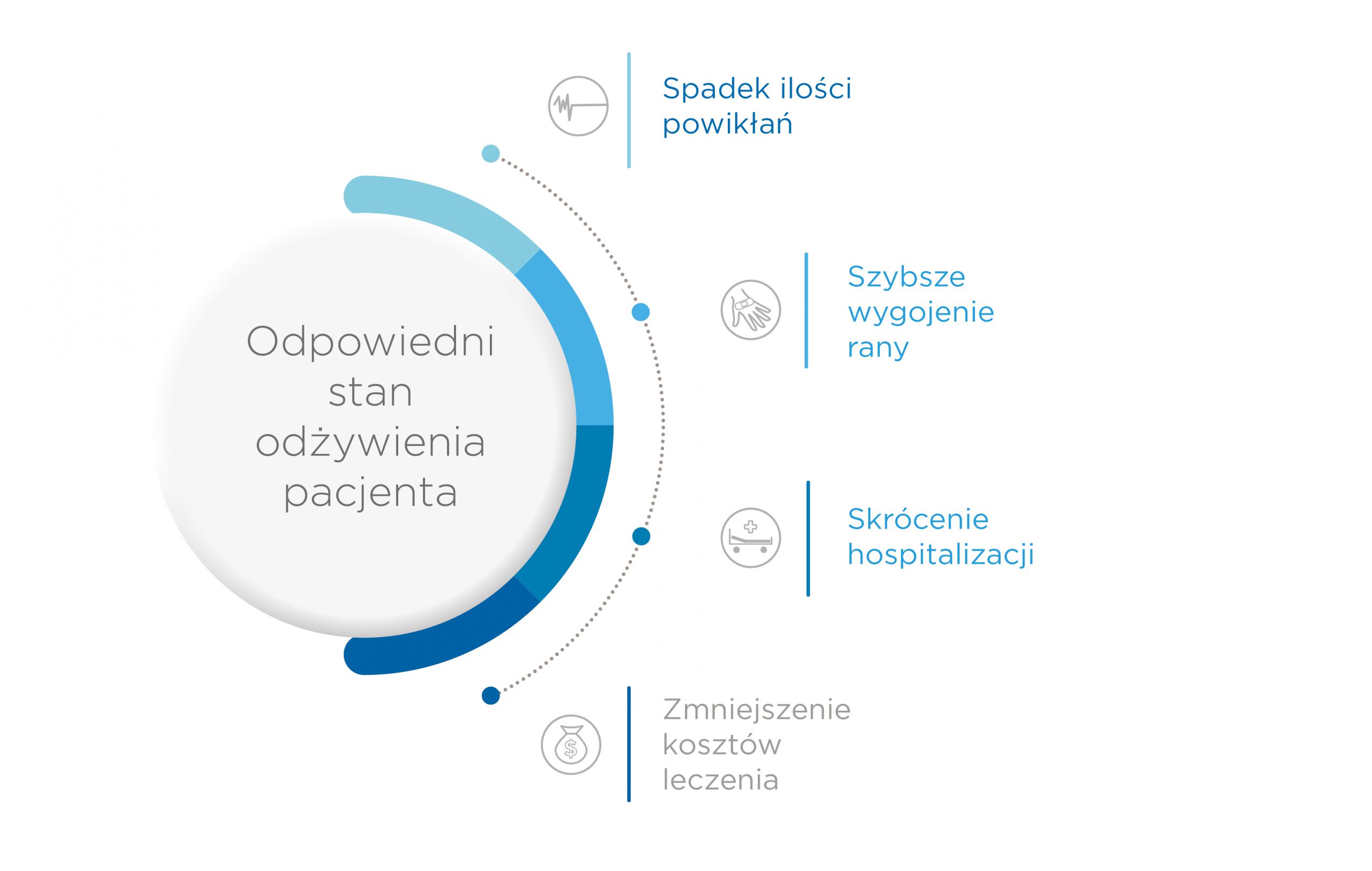
Rycina 2. Efekty właściwego stanu odżywienia u chorych z trudno gojącą się raną
Autor: mgr farm. Ksenia Czech-Staszczyk, Specjalista Farmacji Szpitalnej
Literatura:
1. Bartoszewicz M., Junka A.: Leczenie miejscowe rany przewlekłej objętej procesem infekcyjnym w świetle obowiązujących wytycznych. Leczenie Ran 2012; 9(3): 93-97.
2. Lindholm C., Searle R.: Wound management for the 21st century: combining effectiveness and efficiency. Int Wound J. 2016 Jul;13 Suppl 2:5-15.
3. Wild T., Rahbarnia A., Kellner M., Sobotka L., Eberlein T.: Basics in nutrition and wound healing. Nutrition, 2010 Sept. Vol. 26, Iss.9: 862-866.
4. Quain AM., Khardori NM.: Nutrition in wound care management: a comprehensive overview. Wounds 2015:27(12): 327-335.
5. Sobotka L. (ed.). Basics in Clinical Nutrition. Galen, Prague 2019.
6. Stechmiller J.K.: Understanding the role of nutrition and wound healing. Nutr Clin Pract. 2010 Feb; 25(1): 61-8.
7. x– Saghaleini S.H., Dehghan K., Shadvar K., Sanaie S., Mahmoodpoor A., Ostadi Z.: Pressure Ulcer and Nutrition. Indian J Crit Care Med. 2018 Apr; 22(4): 283-289.
8. Y – Palmieri B., Vadala M., Laurino C.: Nutrition in wound healing: investigation of molecular mechanisms, a narrative review. J Wound Care. 2019 Oct 2; 28(10): 683-693.
9. Klimek M., Szaraniec W., Rojczyk E., Wilemska-Kucharzewska K., Kucharzewski M.: Rola argininy w procesie gojenia ran. Leczenie ran. 2017; 14(3):97-101.
10. Quain AM., Khardori NM. Nutrition in wound care management: a comprehensive overview. Wounds 2015:27(12): 327-335.
11. Guoyao W., Bazer FW., Davis TA., Kim SW., Li P., Rhoads JM., Satterfield MC., Smith SB., Specner TE., Yin Y.: Arginine metabolism and nutrition growth, health and disease. Amino Acids. 2009; 37(1):153-168.
12. Weimann A. i wsp.: ESPEN Guideline: Clinical nutrition in surgery. Clinical Nutrition 40 (2021); 4745-4761.
13. Pattanshetti VM., Powar RS., Godhi AS., Metgud SC. Enteral glutamine supplementation reducing infectious morbidity in burns patients: a randomized controlled trial. Indian J Surg. 2009:71(4):193-7
14. Lorenz KJ., Schallert R., Daniel V. Immunonutrition – the influence of early postoperative glutamine supplementation in enteral/parenteral nutrition on immune response, wound healing and length of hospital stay in multiple trauma patients and patients after extensive surgery. GMS Interdisciplinary Plastic and Reconstructive Surgery DGPW 2015 vol. 4; 1-10
15. Sipahi S., Gungor O., Gunduz M., Cilci M., Demirci MC., Tamer A. The effect of oral supplementation with a combination of beta-hydroxy-beta-methylbutyrate, arginine and glutamine on wound healing: a retrospective analysis of diabetic haemodialysis patients. BMC Nephrology; 2013; 14:8: 1-6.
16. Skrzycki M., Czeczot H. Extracellular superoxide dismutase (EC-SOD) – structure, properties and function. Postepy Hig Med Dosw. (online), 2004:58: 301-311.
17. Berger MM., Baines M., Raffoul W., Benathan M.,m Chiolero RL., Reeves C., Revelly JP., Cayeux MC., Senechaud I., Shenkin A. Trace element supplementation after major burns modulates antioxidant status and clinical course by way of increased tissue trace element concentrations. Am J Clin Nutr 2007; 85:1293-1300.
18. Zinder R., COOLEY R., Vlad L.G., Molnar J.A.: Vitamin A and Wound Healing. Nutr CLin Pract. 2019 Dec;34(6):839-849.
19. Janda K., Kasprzak M., Wolska J. Witamina C – budowa, właściwości, funkcje i występowanie. Pom J Life Sci 2015, 61, 4: 419-425.
20. Carr AC., Maggini S. Vitamin C and immune function. Nutrients. 2017, 9,1211: 1-25.
21. Pullar JM., Carr AC., Vissers MCM. The roles of vitamin C in skin health. Nutrients. 2017; 9,866:1-27.
22. Molnar JA., Underdown MJ., Clark WA. Nutrition and chronic wounds. Advances in wound care. 2014; 3(11): 663-681.

Arginilan
Innowacyjna formuła zawierająca wysoką porcję l-argininy,
hydrolizatu kolagenu, a także wysoce przyswajalny cynk
w postaci chelatu aminokwasowego Albion oraz witaminy A i C.
Czy dieta wysokobiałkowa "niszczy" mikrobiotę jelitową?
Czy dieta wysokobiałkowa "niszczy" mikrobiotę jelitową?
Nie ulega wątpliwości, że białko jest jednym z najważniejszych składników odżywczych u wyniszczonych pacjentów, ponieważ jest zaangażowane w naprawę i regenerację komórek, potrzebne do produkcji enzymów i hormonów, a także uczestniczy w procesie krzepnięcia krwi. W ostatnich latach wiele mówi się o mikrobiocie jelitowej, która czynnie uczestniczy w metabolizmie spożywanego wraz z dietą białka. Fakt ten rodzi istotne z punktu widzenia zdrowia pacjentów pytania np. jak duża ilość białka w diecie wpływa na mikrobiotę jelitową i czy z tej perspektywy zwiększenie ilości tego makroskładnika jest bezpieczne dla pacjentów?
Co dzieje się z białkiem po spożyciu?
Przeważająca część spożytego białka jest trawiona do aminokwasów i/lub peptydów i w tej postaci wchłaniana jest w jelicie cienkim. Jednak szacuje się, że około 10% spożytego białka nie ulega całkowitemu strawieniu i przechodzi do jelita grubego, gdzie podlega proteolizie przez bytujące tam drobnoustroje. Biorąc pod uwagę powyższe informacje, można spodziewać się, że wraz ze wzrostem białka w diecie zwiększa się odsetek niestrawionych białek osiągających jelito grube, prowadząc do produkcji różnych metabolitów bakteryjnych m.in. krótkołańcuchowych kwasów tłuszczowych (SCFA), amoniaku, poliamin, związków fenolowych oraz indolowych, czy siarkowodoru, które biorą udział w różnych funkcjach fizjologicznych i mogą mieć korzystny bądź szkodliwy wpływ na gospodarza w zależności od ich stężenia (Rycina 1). W niektórych pracach naukowych możemy spotkać się z wnioskami, które wskazują na związek między stężeniem wybranych metabolitów, a np. przewlekłym stanem zapalnym lub zwiększonym ryzykiem nowotworu jelita grubego. Warto pamiętać, że korelacja nie wskazuje na związek przyczynowo-skutkowy, a jedynie na współwystępowanie dwóch zmiennych, co oznacza, że na podstawie korelacji nie jesteśmy w stanie stwierdzić, że to zwiększona ilość białka była przyczyną występowania danej jednostki chorobowej.
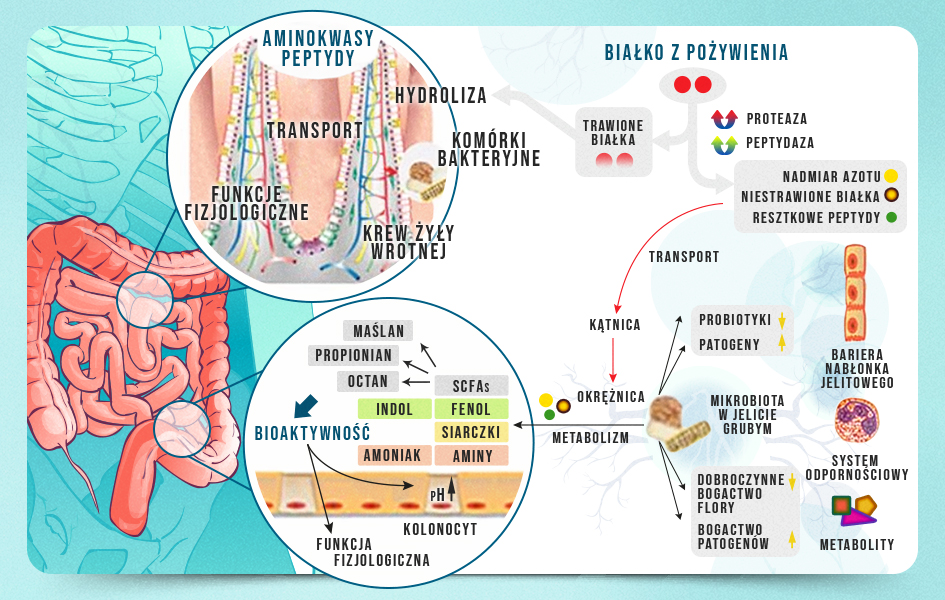
Rycina 1. Losy białka w przewodzie pokarmowym (na podstawie Zhao J. et al. 2019).
Wybrane bakteryjne metabolity fermentacji białek
Krótkołańcuchowe kwasy tłuszczowe (SCFA)
Produkcja SCFA obejmujących octan, propionian i maślan pochodzi przede wszystkim ze spożycia niestrawnych węglowodanów i zachodzi podczas fermentacji bakteryjnej w okrężnicy. Jednakże niestrawione białka są również substratami do produkcji SCFA. Dla przykładu octan może być produkowany przez drobnoustroje jelitowe z glicyny, alaniny, treoniny, glutaminianu, lizyny i asparaginianu; maślan z glutaminianu i lizyny; propionian z alaniny i treoniny. Ilość oraz rodzaj produkowanych SCFA zależy głównie od czasu pasażu jelitowego, składu mikrobioty jelitowej oraz od dostępności substratu. Wiemy, że SCFA są utlenianie i zużywane przez nabłonek okrężnicy. Ponadto mogą aktywować białka odgrywające ważną rolę w modulacji odkładania się tkanki tłuszczowej i wchłaniania składników odżywczych w jelicie. Dodatkowo SCFA biorą udział w różnych procesach fizjologicznych i spełniają ważną rolę w utrzymaniu integralności jelit, regulacji apetytu czy homeostazie glukozy.
Amoniak
Fermentacja białek w jelicie grubym może prowadzić do powstawania związków azotowych takich jak amoniak, czy aminy. Gdy produkty te przekroczą stężenie fizjologiczne, mogą odrywać rolę toksycznych substancji. Stężenie amoniaku w jelicie grubym wiąże się głównie z deaminacją aminokwasów (usunięcie grupy aminowej aminokwasów) i hydrolizą mocznika. Mikrobiota jelitowa używa amoniaku i może on być również wchłaniany przez komórki nabłonka. Mimo że amoniak jest znany ze swoich toksycznych właściwości, to jest również źródłem azotu dla drobnoustrojów bytujących w jelicie grubym. Większość amoniaku jest wydalana z kałem lub wchłaniana w jelitach i wydalana wraz z moczem.
Poliaminy
Są cząsteczkami wytwarzanymi przez kolonocyty z niektórych aminokwasów – arginina, ornityna, metionina, tyrozyna czy histydyna. Drobnoustroje bytujące w okrężnicy mogą wytwarzać różne poliaminy np. agmatynę, putrescynę, kadawerynę, histaminę oraz tyraminę, które biorą udział w aktywności komórkowej drobnoustrojów w zakresie wzrostu, proliferacji, transportu i wydzielania. W konsekwencji skład mikrobioty jelitowej jest jednym z czynników wpływających na profil poliamin obecnych w jelicie grubym.
Siarkowodór
Stanowi rodzaj metabolitu wytwarzanego przez fermentację aminokwasów siarkowych – metioniny i cysteiny. Bakterie jelitowe mogą czerpać energię z łańcucha węglowego cysteiny przez enzym desulfhydrazę cysteinową, natomiast metionina może zostać przekształcona w α-ketomaślan, amoniak, czy metanotiol. Wytwarzanie tych metabolitów przypisuje się określonej grupie taksonomicznej bakterii obecnym w jelicie grubym m.in. Escherichia coli, Salmonella enterica, Clostridium spp. i Enterobacter aerogenes. Siarkowodór jest mocno toksycznym metabolitem, dlatego jego stężenie w świetle okrężnicy jest na poziomie milimolowym. Różne eksperymenty głównie w warunkach in vitro wykazały m.in., że siarkowodór w nadmiernych stężeniach może hamować oddychanie komórkowe w kolonocytach, uszkadzać DNA, czy hamować utlenianie maślanu w komórkach jelita grubego. Powyższe doniesienia mogą sugerować, że siarkowodór podobnie jak amoniak działa niekorzystnie na kolonocyty, jednak dokładniejsza analiza jego funkcji pokazuje, że jego działanie jest zdecydowanie bardziej złożone. Siarczki w odpowiednim stężeniu mogą wspomagać gojenie wrzodów i wywierać działanie przeciwzapalne. Ponadto obserwuje się mitochondrialne utlenianie siarczków, które utrzymywane jest tak długo jak przepływ siarczków nie przekracza komórkowej zdolności utleniania, co z kolei sugeruje, że siarkowodór stanowi pierwsze „paliwo mineralne” dla ludzkich kolonocytów.
Fenole i indole
Mogą powstawać z metabolizmu aminokwasów aromatycznych (fenyloalaniny, tyrozyny i tryptofanu) w jelicie grubym i są podejrzewane o promowanie procesu nowotworzenia. Rodzaje bakterii beztlenowych znanych z fermentacji aminokwasów aromatycznych obejmują Bacteroides, Lactobacillus, Bifidobacterium, Clostridium i Peptostreptococcus. Mogą one wytwarzać szereg związków fenolowych i indolowych m.in. p-krezol, skatol, indol, fenol.
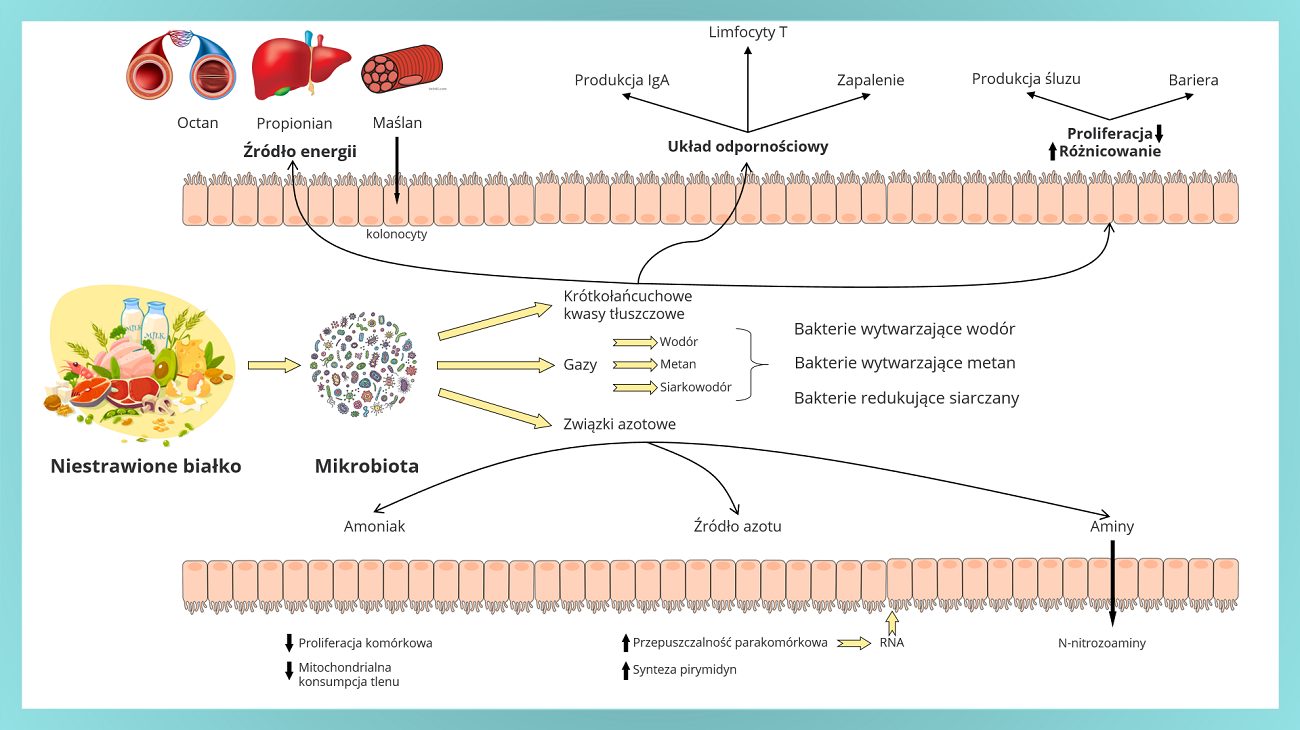
Rycina 2. Białko pokarmowe, jego metabolity i mechanizm homeostazy jelit. SCFA mogą być utleniane i wykorzystywane jako energia dla komórek okrężnicy. Oprócz roli w metabolizmie energetycznym są również ważnymi modulatorami układu odpornościowego, sprzyjają wytwarzaniu śluzu i zachowaniu bariery jelitowej. Produkcja gazów takich jak metan, wodór, siarkowodór wiąże się ze zmianą bakterii fermentacyjnych, które odgrywają kluczową rolę w systemach beztlenowych. Dodatkowo działanie związków azotu można podsumować jako hamowanie proliferacji komórkowej, konsumpcji tlenu oraz aktywację syntezy pirymidyn i zwiększanie przepuszczalności parakomórkowej (na podstawie Ma i wsp. 2017).
Czy rodzaj białka ma znaczenie?
Z przedstawionych wyżej danych wynika, że mikrobiota jelitowa ma dużą moc proteolityczną, co zostało przedstawione m.in. w pracy Macfarlane i Cummings jeszcze w 1986 roku. Badania przeprowadzone na modelach zwierzęcych wykazały większą różnorodność mikrobiologiczną u zwierząt karmionych białkami pochodzenia roślinnego w porównaniu do zwierząt karmionych białkami podchodzenia zwierzęcego oraz zwiększoną liczebność rzędu Bacteroidales S24-7 u zwierząt otrzymujących karmę z białkiem sojowym. Li i wsp. oceniali wpływ diety wysokobiałkowej i niskowęglowodanowej u psów i zanotowali obniżony stosunek rodzaju Bacteroides do Prevotella oraz zwiększoną liczebność Clostridium hiranonis, Clostridium perfringens i Ruminococcus gnavus. Zasugerowano, że ostatnie z wymienionych bakterii mogą mieć korzystne działanie w ludzkich jelitach.
Również w badaniach z udziałem ludzi spożycie białka zostało dodatnio skorelowane z różnorodnością mikrobioty jelitowej. Dane te pochodzą z badań przeprowadzonych na zdrowych ochotnikach, sportowcach oraz osobach z nadwagą i otyłością. Również w tych eksperymentach źródło białka wydaje się mieć znaczenie, ponieważ w przypadku podaży białek pochodzenia roślinnego zanotowano większą liczebność: Bifidobacterium, Lactobacillus, Roseburia, Eubacterium rectale, oraz Ruminococcus bromii, natomiast mniejszą liczebność Bacteroides i Clostridium perfringens. Spożycie białek pochodzenia zwierzęcego wiązało się wyższą liczebnością Bacteroides, Alistipes, Bilophila i Clostridium perfrigens.
Wysoka liczebność Bacteroides została odnotowana u osób spożywających typową dietę zachodnią, bogatą w białko i tłuszcze zwierzęce, jednak sugeruje się, że to właśnie różnice w zawartości tłuszczu, a nie białka są głównym czynnikiem wzrostu tego rodzaju bakterii. Warto dodać, że odnotowano istotne zależności pomiędzy zwiększonym stężeniem SCFA w kale, Prevotella i niektórych Firmicutes, a spożywaniem diety śródziemnomorskiej. Dieta ta cechuje się mniejszą zawartością białka zwierzęcego, ale jednocześnie wyższym odsetkiem białka roślinnego, a co najważniejsze wysoką zawartością błonnika, który jest jednym z kluczowych czynników przyczyniających się do zachowania różnorodności mikrobioty jelitowej. Warto podkreślić, że większość źródeł białka roślinnego jest również bogata w błonnik, podczas gdy białko pochodzenia zwierzęcego niekoniecznie, dlatego jest wysoce prawdopodobne, że to właśnie błonnik jest głównym czynnikiem wpływającym na różnorodność mikrobioty jelitowej w przeprowadzonych pracach.
Co w takim razie z osobami chorymi?
Mikrobiom jelitowy pacjentów w stanie krytycznym różni się od tego u osób zdrowych. Zmiany fizjologiczne związane z przebiegiem choroby prowadzą do głębokich zmian w składzie i funkcjach mikrobiomu jelitowego, co może być związane z aktywacją układu immunologicznego i progresją niewydolności narządów. Badania wykazały, że u pacjentów w stanie krytycznym może dojść do prawie całkowitej utraty prozdrowotnej mikrobioty wraz z przerostem zjadliwych patogenów.
Suplementacja wysokoenergetyczną i wysokobiałkową żywnością specjalnego przeznaczenia medycznego (taką jak Nutramil Complex® Protein), bez wątpienia może przynosić korzyści dla pacjentów, szczególnie jeśli chodzi poprawę stanu odżywienia, czy częściową ochronę przed spadkiem beztłuszczowej masy ciała. Dysponujemy jednak ograniczonym zasobem badań naukowych, które pozwoliłby dokładnie scharakteryzować możliwą modulację tych efektów przez mikrobiotę jelitową. Większość dotychczasowych prac oceniała prawie wyłącznie skład mikrobioty jelitowej, a nie jej pojemność funkcjonalną mikrobiomu. Ocena różnic w genach drobnoustrojów zaangażowanych w metabolizm białka pomiędzy osobami różniącymi się odpowiedzią anaboliczną na podaż białka może doprowadzić do opracowania nowych probiotyków o specyficznej zdolności do wpływania na syntezę białek mięśniowych.
Białko, seniorzy i mikrobiom
W badaniu Ford i wsp. (2020), którego celem była ocena wpływu spożycia diety wysokobiałkowej (1,5-2,2 g/kg/dzień) bez probiotyku i z probiotykiem u starszych kobiet, stwierdzono, że dieta wysokobiałkowa nie wpływała na zmianę składu mikrobioty jelitowej w okresie dwóch tygodni. W innym badaniu Sergeev i wsp. (2020) wykazali, że utrata masy ciała u osób stosujących wysokobiałkową, niskowęglowodanową i ubogoenergetyczną dietę wiąże się ze zmianami w mikrobiocie jelitowej. Stosowanie synbiotyku zwiększało liczebność Bifidobacterium i Lactobacillus podczas wprowadzonego programu redukcji masy ciała opierającego się na wysokobiałkowej i niskowęglowadanowej diecie w porównaniu z grupą przyjmującą placebo. Ponadto, w kilku pracach wykazano, że wysokobiałkowe, ale niskowęglowodanowe diety u osób otyłych powodują zmniejszenie liczebności Roseburia i Eubacterium rectale, odpowiedzialnych za produkcję maślanu. Co ciekawe, wyniki tych prac wskazują, że zmieniony skład mikrobioty jelitowej jest wywoływany przez obniżenie spożycia węglowodanów w diecie, a nie tylko przez podwyższenie spożycia białka. Dysponujemy jednak pracami na modelu zwierzęcym sugerującymi, że zwiększona ilość białka w diecie w przeciwieństwie do jego umiarkowanego spożycia powoduje zmiany w składzie mikrobioty jelitowej – obniżenie liczebności bakterii rodzajów Roseburia, Faecalibacterium i Clostridium XIVa odpowiedzialnych za produkcję maślanu, a także zwiększona ilość Firmicutes. Wyniki niektórych badań zostały podsumowane w poniższej tabeli 1.
Tabela 1. Zmiany w mikrobiocie jelitowej i zmiany metaboliczne po dietach wysokobiałkowych i niskowęglowodanowych.
Przedstawione wyżej dane sugerują, że dostępność węglowodanów złożonych może zmniejszyć fermentację białka, prowadząc do pozyskiwania większej ilości substratów azotowych, które mogą promować anabolizm mięśni u seniorów. Wydaje się, że zadbanie o odpowiednie dostarczanie węglowodanów złożonych szczególnie podczas spożywania diety wysokobiałkowej może mieć kluczowe znaczenie nie tylko dla zdrowia metabolicznego, ale również dla zdrowia mięśni szkieletowych.
Podsumowanie
Niestrawione białko i aminokwasy są fermentowane do różnych metabolitów mogących wywierać zarówno pozytywny jak i negatywny wpływ na zdrowie gospodarza. Proces ten jest w dużym stopniu uzależniony od ich stężenia w świetle jelita, potencjału działania i wielu innych czynników, do których można zaliczyć np. rodzaj spożywanego białka, czy ilość węglowodanów w diecie.
Strategie żywieniowe ukierunkowane na modulację mikrobioty jelitowej wydają się być użytecznym narzędziem do poprawy zdrowia przewodu pokarmowego, jednak na tę chwilę posiadamy zbyt małą liczbę badań nad wpływem białka na mikrobiotę jelitową, aby móc dokładnie wyjaśnić związek między funkcją drobnoustrojów, a zdrowiem jelit. Ponadto, większość badań została przeprowadzona w warunkach in vitro i na modelach zwierzęcych, co oznacza, że ekstrapolacja tych wyników na pacjentów jest kłopotliwa. W końcu powstaje jedno z kluczowych pytań, czy biorąc pod uwagę wszystkie za i przeciw ograniczenie spożycia pełnowartościowego białka w grupie pacjentów z niedożywieniem białkowo-kalorycznym jest dobrym rozwiązaniem, nawet jeśli część białka miałaby ulec fermentacji do wymienionych w artykule metabolitów?
Autor: Konrad Klekot
Literatura:
1. Zhao J, Zhang X, Liu H, Brown MA, Qiao S. Dietary Protein and Gut Microbiota Composition and Function. Curr Protein Pept Sci. 2019;20(2):145-154.
2. Rowland I, Gibson G, Heinken A, Scott K, Swann J, Thiele I, Tuohy K. Gut microbiota functions: metabolism of nutrients and other food components. Eur J Nutr. 2018 Feb;57(1):1-24.
3. Ma N, Tian Y, Wu Y, Ma X. Contributions of the Interaction Between Dietary Protein and Gut Microbiota to Intestinal Health. Curr Protein Pept Sci. 2017;18(8):795-808.
4. Li Q., Lauber C.L., Czarnecki-Maulden G., Pan Y., Hannah S.S. Effects of the dietary protein and carbohydrate ratio on gut microbiomes in dogs of different body conditions. MBio. 2017;8:1–14.
5. Ni Lochlainn M, Bowyer RCE, Steves CJ. Dietary Protein and Muscle in Aging People: The Potential Role of the Gut Microbiome. Nutrients. 2018 Jul 20;10(7):929.
6. Ford AL, Nagulesapillai V, Piano A, Auger J, Girard SA, Christman M, Tompkins TA, Dahl WJ. Microbiota Stability and Gastrointestinal Tolerance in Response to a High-Protein Diet with and without a Prebiotic, Probiotic, and Synbiotic: A Randomized, Double-Blind, Placebo-Controlled Trial in Older Women. J Acad Nutr Diet. 2020 Apr;120(4):500-516.e10.
7. Prokopidis K, Cervo MM, Gandham A, Scott D. Impact of Protein Intake in Older Adults with Sarcopenia and Obesity: A Gut Microbiota Perspective. Nutrients. 2020 Jul 30;12(8):2285.
8. Sergeev I.N., Aljutaily T., Walton G., Huarte E. Effects of synbiotic supplement on human gut microbiota, body composition and weight loss in obesity. Nutrients. 2020;12:222.
9. Duncan S.H., Belenguer A., Holtrop G., Johnstone A.M., Flint H.J., Lobley G.E. Reduced dietary intake of carbohydrates by obese subjects results in decreased concentrations of butyrate and butyrate-producing bacteria in feces. Appl. Environ. Microbiol. 2007;73:1073–1078.
10. Vidal-Lletjos S., Andriamihaja M., Blais A., Grauso M., Lepage P., Davila A.M., Viel R., Gaudichon C., Leclerc M., Blachier F., et al. Dietary protein intake level modulates mucosal healing and mucosa-adherent microbiota in mouse model of colitis. Nutrients. 2019;11:514.
11. Russell W.R., Gratz S.W., Duncan S.H., Holtrop G., Ince J., Scobbie L., Duncan G., Johnstone A.M., Lobley G.E., Wallace R.J., et al. High-protein, reduced-carbohydrate weight-loss diets promote metabolite profiles likely to be detrimental to colonic health. Am. J. Clin. Nutr. 2011;93:1062–1072.
12. Rowland I, Gibson G, Heinken A, Scott K, Swann J, Thiele I, Tuohy K. Gut microbiota functions: metabolism of nutrients and other food components. Eur J Nutr. 2018 Feb;57(1):1-24.
13. Yang Q, Liang Q, Balakrishnan B, Belobrajdic DP, Feng QJ, Zhang W. Role of Dietary Nutrients in the Modulation of Gut Microbiota: A Narrative Review. Nutrients. 2020 Jan 31;12(2):381.

Nutramil Complex Protein
Preparat wysokobiałkowy do stosowania przy niedożywieniu, w chorobie nowotworowej, w okresie okołooperacyjnym, w czasie rekonwalescencji, w chorobach układu pokarmowego.
Rola białka w chorobie nowotworowej
Rola białka w chorobie nowotworowej
W artykule wyjaśnimy, jaka jest rola białka w chorobie nowotworowej. Należy zacząć od tego, że dorosły, zdrowy człowiek potrzebuje w ciągu doby dostarczyć wraz z dietą ok. 0,8-1 g białka na każdy 1 kg swojego ciała. Chory na nowotwór wymaga już znacznie większej podaży, bo między 1,2, a 1,5 g protein/kg m.c./dzień. Białko będzie mu bowiem niezbędne dla m.in. utrzymania stabilnej masy mięśniowej i siły fizycznej, wzmocnienia odporności oraz usprawnienia procesu gojenia się ewentualnych ran albo odleżyn. Do czego jeszcze potrzebne jest białko, kiedy zwiększyć jego podaż i gdzie szukać najlepszych źródeł?
Leczenie onkologiczne to bardzo często długotrwały i pełen zwrotów akcji proces. W związku z jego następstwami, które niejednokrotnie zakłócają przebieg terapii, coraz częściej mówi się o tym, że sama interwencja lekarska nie wystarczy. Aby więc pacjent mógł odnieść możliwie najwyższe korzyści z wdrożonego leczenia, musi być do niego właściwie przygotowany, a na dalszych etapach jego trwania — pozostawać pod opieką multidyscyplinarnego zespołu, który zadba o stan ogólny, samopoczucie fizyczne oraz psychiczne chorego. Elementem takiego postępowania będzie prawidłowo dobrane żywienie.
Niedożywienie w chorobie nowotworowej
Wśród istotnych aspektów związanych z leczeniem przeciwnowotworowym, pojawia się termin „niedożywienia”. Zgodnie z definicją ESPEN (ang. The European Society for Clinical Nutrition and Metabolism), niedożywienie to “stan wynikający z braku wchłaniania lub spożywania substancji żywieniowych, prowadzący do zmiany składu ciała, upośledzenia fizycznej i mentalnej funkcji organizmu oraz negatywnie wpływający na rezultaty leczenia choroby podstawowej”. Podczas terapii onkologicznej, ryzyko wystąpienia niedożywienia, wiąże się z m.in.:
- obecnością samej zmiany nowotworowej, która doprowadza do aktywacji ogólnoustrojowego zapalenia (a w konsekwencji skutkującego m.in. utratą masy ciała, zmianami w jego składzie oraz pogorszeniem się sprawności fizycznej);
- zaburzeniami wchłaniania pojawiającymi się zwłaszcza u osób po radykalnych interwencjach chirurgicznych na przewodzie pokarmowym (np. po gastrektomii, resekcji części jelita);
- zwiększonym zapotrzebowaniem na składniki odżywcze w przebiegu np. zakażenia czy gorączki;
- niepożądanymi następstwami terapii, takimi jak nudności, wymioty, problemy z wypróżnieniami.
W konsekwencji obserwuje się pogorszenie funkcji układu odpornościowego u chorego, zmniejszenie tempa oraz jakości gojenia się ran, a także trudności w procesie rehabilitacji i rekonwalescencji. Finalnie, maleje efektywności terapii, a co za tym idzie – pogarsza rokowanie.
Wśród interwencji żywieniowych koniecznych do wprowadzenia u pacjenta onkologicznego wymienia się m.in. dbałość o dostarczenie odpowiedniej ilości białka.
Czym jest białko i jaką rolę pełni w naszym organizmie?
Białko – najważniejsze funkcje w ludzkim organizmie
Białka stanowią podstawowy budulec wszystkich żywych organizmów. Zbudowane są z pojedynczych aminokwasów, które w zależności od funkcji jaką pełnią w żywieniu człowieka, dzieli się na dwie grupy:
- aminokwasy niezbędne (egzogenne), których organizm nie potrafi sam zsyntetyzować i należy dostarczyć je wraz z dietą (histydyna, izoleucyna, leucyna, lizyna, metionina, fenyloalanina, treonina, tryptofan, walina);
- aminokwasy nie-niezbędne (endogenne), czyli takie, które mogą zostać zsyntetyzowane w organizmie; dzieli się je z kolei na:
- aminokwasy, które organizm potrafi zsyntetyzować w ilości w całości pokrywającej zapotrzebowanie, niezależnie od czynników zewnętrznych w tym np. zmienionego stanu fizjologicznego (alanina, asparagina, kwas glutaminowy, kwas asparaginowy, seryna);
- aminokwasy, które są niezbędne w wybranych warunkach fizjologicznych i/lub patologicznych, kiedy ich endogenna produkcja nie pokryje zapotrzebowania organizmu (glutamina, cysteina, arginina, glicyna, prolina, tyrozyna).
Prócz roli strukturalnej i funkcjonalnej, białka są ponadto regulatorami ekspresji genów, wchodzą w skład rozmaitych układów enzymatycznych oraz uczestniczą w regulacji wielu procesów metabolicznych. Ich rolę w organizmie człowieka można powiązać z trzema, głównymi obszarami:
- wzrostem i odbudową (np. nieustanne procesy budowy zachodzące m.in. podczas gojenia się ran, odleżyn, tworzenia blizn);
- regulacją procesów życiowych (np. udział w procesach obronnych organizmu poprzez produkcję przeciwciał);
- utrzymaniem równowagi organizmu (np. zachowanie równowagi wodnej i kwasowo-zasadowej).
Rola białka w chorobie nowotworowej
Choroba nowotworowa wiąże się z wieloma następstwami. Brak apetytu, nudności w przebiegu podawania leków, gorączka, konsekwencje przebytych zabiegów, w tym trudno gojące, wysiąkające rany, w negatywny sposób wpływają na możliwość utrzymania stabilnej, należnej masy ciała. Obniżenie jej w krótkim czasie już o 5-10% stanowi sygnał alarmowy oraz rosnące ryzyko rozwoju niedożywienia i jego powikłań. W związku z powyższym uważa się, że dieta o zwiększonej podaży m.in. białka będzie wskazana zwłaszcza w przypadku:
- przygotowania do operacji i w okresie rekonwalescencji po jej przebyciu;
- podczas leczenia chemio- i radioterapeutycznego;
- w okresie zwiększonej częstotliwości infekcji;
- przy długotrwałej gorączce;
- przy trudno gojących się ranach i odleżynach, zwłaszcza przy dużym wysięku z nich.
Jak już wcześniej wspomniano, średnie zapotrzebowanie na białko u zdrowego człowieka wynosi ok. 0,8 g protein na każdy kilogram masy ciała na dobę. Chory na nowotwór potrzebuje ich natomiast przynajmniej 1,5-2 razy więcej (ok. 100 g dziennie). Według aktualnych wytycznych ESPEN rekomenduje się podaż białka na poziomie najlepiej wyższym niż 1 g, do 1,5 g/kg m.c. w ciągu doby.
Źródło białka
Najbogatszymi źródłami białka o najwyższej wartości biologicznej będą przede wszystkim produkty pochodzenia zwierzęcego – mięso, nabiał oraz jaja. Protein warto także szukać w nasionach roślin strączkowych i ich przetworach (np. tofu) – oczywiście pod warunkiem, że nie istnieją przeciwwskazania do ich spożywania. Gdy jednak tradycyjna dieta nie będzie wystarczająca, np. z powodu trudności w przyjmowaniu większej objętości pokarmów, do codziennego jadłospisu rekomenduje się włączyć tzw. ONSy (ang. oral nutritional supplements), czyli odżywki specjalnego przeznaczenia medycznego. Preparaty te dostarczają znacznej liczby kalorii oraz białka w niewielkiej ich porcji. Ponieważ występują pod wieloma postaciami oraz smakami, z łatwością można dobrać idealne dla konkretnego pacjenta i jego sytuacji.
UWAGA!
Zwiększona podaż białka w diecie powinna korelować ze specjalistyczną poradą. W wybranych przypadkach, np. u osób z nieprawidłową czynnością nerek, wyższy udział protein może być niewskazany. Wszelkie kwestie w tym zakresie powinny więc zostać omówione z lekarzem prowadzącym i/lub doświadczonym dietetykiem klinicznym.

Literatura:
1 Kłęk S., Kapała A. 2019. Leczenie żywieniowe. Varia Medica, 3(1):77-87.
2. ESPEN Guideline. Muscaritoli M. i in. 2021. ESPEN practical quideline: Clinical Nutrition in cancer. Clinical Nutrition, 40(2021):2898-2913.
3. Jarosz M. 2016/2017, Żywność, żywienie w prewencji i leczeniu, Instytut Żywności i Żywienia, W-wa.
4. Jarosz M. 2017. Normy żywienia dla populacji Polski. Instytut Żywności i Żywienia, W-wa
Autor: mgr Maria Brzegowy
dietetyk, specjalista żywienia klinicznego

Nutramil Complex Protein
Nutramil Complex Protein w jednej porcji dostarcza organizmowi aż 18,8 g wysokoprzyswajalnego białka (3 rodzaje białka o różnej kinetyce wchłaniania).
Wsparcie żywieniowe pacjenta po COVID-19
Wsparcie żywieniowe pacjenta po COVID-19
Pacjenci ciężko przechodzący COVID-19 są podatni na znaczną utratę masy ciała i kacheksję [1], będących wynikiem niedożywienia, jak również złożonych zmian metabolicznych. Są one uważane za główną przyczynę ostrych problemów klicznicznych, jak i długoterminowego uszczerbku na zdrowiu, dlatego w leczeniu należy również skupić się na żywieniu i rehabilitacji [3]. Ciężkie przejście choroby zwiększa prawdopodobieństwo wystąpienia niedożywienia, dlatego wsparcie żywieniowe pacjenta po COVID-19 jest równie ważne, jak podczas leczenia [4]. Z dotychczas opublikowanych prac wynika, że nawet 40% pacjentów trafiających do szpitala może być niedożywionych, podczas gdy przy wypisie odsetek ten może dotyczyć nawet 70% pacjentów.
Wsparcie żywieniowe pacjenta po COVID-19 w leczeniu utraty mięśni szkieletowych
Kryteria rozpoznawania niedożywienia obejmują niezamierzoną utratę masy ciała, redukcję masy mięśniowej, niskie BMI, mniejsze spożycie i przyswajanie składników odżywczych oraz stany zapalne związane z urazem lub chorobą. Trzyetapowe badanie stanu odżywienia na podstawie globalnych kryteriów diagnozowania niedożywienia opisaliśmy w poradniku, z którego dowiesz się, jak diagnozować niedożywienie.
Utrata masy mięśniowej następuje wraz z wiekiem i ma związek z chorobami przewlekłymi, ale nie tylko. Do nagłego zmniejszenia masy mięśniowej dochodzi podczas pilnej hospitalizacji. Natomiast pobyt na oddziale intensywnej terapii powoduje gwałtowną utratę masy mięśniowej wraz z utratą masy ciała. Odbudowa mięśni trwa znacznie dłużej niż ich ubytek, dlatego bardzo ważna jest szybka interwencja i systematyczna pomoc pacjentom w odzyskiwaniu masy mięśniowej. Utratę
i odbudowę mięśni można porównać z płonącym lasem, którego ponowne zalesienie trwa bardzo długo. Żeby do niej nie dopuścić, w zależności od potrzeb i stanu pacjenta, można stosować żywność, suplementy, żywienie dojelitowe lub pozajelitowe [5].
Według badań pacjenci na oddziałach intensywnej terapii oraz po poważnych zabiegach operacyjnych mogą tracić nawet 1 kg beztłuszczowej masy ciała dziennie [6]. Spadek beztłuszczowej masy ciała zwiększa ryzyko komplikacji i śmiertelność [7]. Niska masa mięśniowa kończyn dolnych może prowadzić do niepełnosprawności i ograniczeń funkcjonalnych, dlatego wsparcie żywieniowe pacjentów po COVID-19 jest ogromnie istotne w celu przyspieszenia procesu rehabilitacji. Warto zwracać na to szczególną uwagę, ponieważ część pacjentów po wyjściu ze szpitala nigdy nie odzyska utraconej masy mięśniowej [8].
Siedzący i aktywny tryb życia a COVID-19
COVID-19, w tym ograniczenia związane z kwarantanną i izolacją wpłynęły na stan zdrowia i kondycję ludzi na całym świecie. Już zmniejszenie codziennej liczby kroków (<1000) w ciągu dwóch tygodni powoduje utratę beztłuszczowej masy kończyn dolnych u zdrowych młodych osób i starszych dorosłych [9]. Ponadto, tryb życia osób starszych negatywnie wpływa na ich masę mięśniową, układ sercowo-naczyniowy i metabolizm. Siedzący tryb życia przyczynia się do zmniejszenia masy, siły i mocy mięśniowej, insulinowrażliwości i spadku VO2max. Natomiast aktywność fizyczna zapobiega spadkowi VO2max i wzrostowi tkanki tłuszczowej u seniorów, poprawia wydolność sercowo-oddechową i pozwala utrzymać masę, siłę i moc mięśniową oraz połączenia nerwowo-mięśniowe w zdrowiu [10].
Zasady wsparcia żywieniowego pacjenta po COVID-19
Główne zasady żywienia klinicznego pacjentów po COVID-19 to zapobieganie oraz leczenie niedożywienia związanego z chorobą, wspomaganie leczenia jednostki chorobowej poprzez leczenie żywieniowe, przeciwdziałanie utracie masy mięśniowej, ułatwianie rehabilitacji i wspieranie dobrego samopoczucia pacjenta. Prawidłowe odżywianie nie odwraca kacheksji, ale może zapobiec bądź zminimalizować utratę mięśni, złagodzić objawy, poprawić jakość życia i wyniki. Leczenie utraty mięśni może łączyć różne strategie żywieniowe, w tym stosowanie:
- odpowieniej ilości wysokiej jakości białka,
- aminokwasów i ich pochodnych – HMB, L-leucyna, Kreatyna,
- kwasów tłuszczowych OMEGA-3,
- żywności wysokoenergetycznej (np. Nutramil Complex® Protein),
- podejścia wielokierunkowego – diety, suplementacji, aktywność fizycznej [11].
Dwa randomizowane, kontrolowane badania kliniczne niedożywionych pacjentów z POChP wykazały, że stosowanie doustnych suplementów pokarmowych (ONS) przyczynia się do znacznego wzrostu masy ciała i poprawy wydolności fizycznej [12]. Istotne jest przestrzeganie zaleceń, co pokazało badanie 33 pacjentów ambulatoryjnych z POChP przeprowadzone na dwóch grupach – A (21 pacjentów) i B (12 pacjentów). Obie grupy korzystały ze wsparcia dietetycznego. Jednak grupa A otrzymała zalecenie zakupu ONS, podczas gdy grupa B dostała ONSy za darmo. Tylko 41% pacjentów z grupy A i 58% z grupy B zgłosiło spożywanie ONS w 12 tygodniu. Pacjenci stosujący ONS
w 12 tygodniu zwiększyli swoją masę ciała [13].
Jak pomóc sobie lub swoim pacjentom?
- W zapobieganiu utraty masy mięśniowej pomoże Ci codzienna aktywność fizyczna, odpowiednia jakość diety i suplementacja.
- Aktywnością fizyczną jest zarówno trening, jazda na rowerze, piesze wycieczki czy spacery, jak i codzienne domowe czynności.
- Zadbaj o wysoką jakość białka w odpowiedniej ilości, czyli 20-40 g na posiłek – możesz skorzystać z żywności specjalnego przeznaczenia medycznego Olimp LiveUp.
- W celu zmaksymalizowania efektów rehabilitacji wprowadź codzienną suplementację – 3-5g kreatyny, 2-4g oleju rybiego (Gold Omega 3®) i witaminę D3, w zależności od niedoborów 1000-4000 IU/dziennie (Gold-Vit® D3).
- Kreatyna przyczyni się do większej tolerancji wysiłku, regeneracji i odzyskiwania mięśni. Przeciwzapalne właściwości oleju rybiego korzystnie działają na organizm w ciężkich infekcjach COVID-19. Niski poziom witaminy D3 jest potencjalnym czynnikiem ryzyka zakażenia COVID-19. Przyjmuje się, że suplementacja zmniejsza ryzyko sarkopenii i COVID-19.
- Regularny kontakt z pacjentem, który otrzymuje porady i informacje zwrotne, wpłynie na stosowanie się przez niego do zaleceń wydawanych w ramach wsparcia żywieniowego po COVID-19 [14].
Kluczowe w o opiece pacjentów z COVID-19 są badania przesiewowe, diagnoza niedożywienia bazująca na kryteriach fenotypowych i etiologicznych GLIM, skoordynowane, ukierunkowane i multimodalne leczenie oraz monitorowanie stanu zdrowia pacjenta.

Bibliografia:
1, 3. Anker MS, et al. Weight loss, malnutrition, and cachexia in COVID-19: facts and numbers,
J Cachexia Sarcopenia Muscle, 2021 Feb;12(1):9-13. doi: 10.1002/jcsm.12674.
2. Laviano A., Koverech A., Mari A. Cachexia: clinical features when inflammation drives malnutrition, Proc Nutr Soc, 2015 Nov;74(4):348-54.
4. Nalbandian A, et al. Post-acute COVID-19 syndrome. Nature Medicine,2021 Apr;27(4):601-615.
5,7. Prado CM, Anker SD, Coats AJS, Laviano A, von Haehling S. Nutrition in the spotlight in cachexia, sarcopenia and muscle: avoiding the wildfire. J Cachexia Sarcopenia Muscle. 2021 Feb;12(1):3-8.
6. Wischmeyer PE, San-Millan I. Winning the war against ICU-acquired weakness: new innovations in nutrition and exercise physiology. Crit Care. 2015;19 Suppl 3(Suppl 3):S6.
8. Marshall RN, Smeuninx B, Morgan PT, Breen L. Nutritional Strategies to Offset Disuse-Induced Skeletal Muscle Atrophy and Anabolic Resistance in Older Adults: From Whole-Foods to Isolated Ingredients. Nutrients. 2020 May 25;12(5):1533.
9. Oikawa SY, Holloway TM, Phillips SM. The Impact of Step Reduction on Muscle Health in Aging: Protein and Exercise as Countermeasures. Front Nutr. 2019 May 24;6:75.
10. Moro T, Paoli A. When COVID-19 affects muscle: effects of quarantine in older adults. Eur J Transl Myol, 2020 Jun 13; 30(2): 9069.
11. Prado CM, Anker SD, Coats AJS, Laviano A, von Haehling S. Nutrition in the spotlight in cachexia, sarcopenia and muscle: avoiding the wildfire. Journal of Cachexia Sarcopenia Muscle. 2021 Feb;12(1):3-8.
12. Collins PF, et al. Nutritional support in chronic obstructive pulmonary disease (COPD): an evidence update, J Thorac Dis. 2019 Oct; 11(Suppl 17): S2230–S2237.
13. Collins PF, et al. Nutritional support in chronic obstructive pulmonary disease (COPD):
A randomised trial, September 2018, Clinical Nutrition 37:S215-S216.
14. Kirwan R, et al. Sarcopenia during COVID-19 lockdown restrictions: long-term health effects of short-term muscle loss, GeroScience, 42, 1547-1578 (2020).
Autor: Redakcja

Nutramil Complex
Kompozycja niezbędnych składników odżywczych: białek, węglowodanów, tłuszczów, witamin oraz mikro i makroelementów (w tym minerałów w postaci wysoko przyswajalnych chelatów aminokwasowych Albion®).
Stopa cukrzycowa – profilaktyka i leczenie
Stopa cukrzycowa – profilaktyka i leczenie
Stopa cukrzycowa jako powikłanie niekontrolowanej lub nieleczonej cukrzycy, stanowi coraz większy problem wśród populacji diabetyków, gdyż dotyczy ok. 200 tys. osób w Polsce.
Badania dowodzą, że Zespół Stopy Cukrzycowej występuje u 0,6-2% chorych na cukrzycę typu 1 oraz aż u 12-18% osób z cukrzyca typu 2. Ryzyko pojawienia się owrzodzenia w ciągu życia osoby chorej na cukrzycę wynosi około 25-30%. Mimo wysokiego poziomu medycyny oraz wczesnej prewencji powikłań, liczba ta na przestrzeni lat stale rośnie. W 85% przypadków amputację kończyny poprzedza owrzodzenie, które w większości przypadków można skutecznie wyleczyć. Kluczowa jest edukacja pacjenta na temat profilaktyki stopy cukrzycowej. Mówi się, że cukrzyk, który wie więcej – żyje dłużej.
Zapobieganie stopie cukrzycowej
Dlatego każdy diabetyk powinien znać zasady prewencji Zespołu Stopy Cukrzycowej, na które składa się:
- Codzienne oglądanie stóp, również od strony podeszwowej np. lusterkiem oraz skóry między palcami.
- W przypadku zauważenia zmiany na skórze należy bezzwłocznie zdezynfekować antyseptykiem, zaopatrzyć jałowym opatrunkiem i jak najszybciej skontaktować się ze specjalistą – najlepiej jest udać się do specjalistycznego gabinetu leczenia ran/gabinetu stopy cukrzycowej.
- Unikanie urazów mechanicznych (np. skaleczenia przez ciała obce, za ciasne obuwie), urazów termicznych (np. poparzenie gorącą wodą, stanięcie na rozgrzanym piasku na plaży), unikanie działania żrących płynów na skórę (np. kwasy na odciski, skarpetki złuszczające, kremy z mocznikiem w dużym stężeniu).
- Regularne wizyty u podologów, diabetologów oraz chirurga naczyniowego, kardiologa itd.
- Szybką identyfikację infekcji w obrębie stóp (np. grzybica) oraz natychmiastowe rozpoczęcie leczenia.
- Codzienną higienę stóp, na którą składa się mycie stóp w wodzie o temperaturze poniżej 37° C (unikanie szarego mydła w kostce), polecane mycie pod bieżącą wodą, aby nie spowodować maceracji skóry w wyniku namaczania. Dokładne osuszenie skóry miękkim ręcznikiem, szczególnie w przestrzeniach między palcami. Zabronione jest suszenie stóp za pomocą suszarki.
- Stosowanie balsamów nawilżających na suchą skórę.
- Obcinanie paznokci na prosto, a nie okrągło, chroniąc paznokieć przed wrastaniem w skórę.
- Używanie pilnika zawsze w jednym kierunku, aby nie powodować uszkodzenia płytki paznokcia.
- Nieużywanie ostrych przyborów do pielęgnacji stóp, nie zaleca się używania pumeksu, tarki itd.
- Unikanie przyklejania plastrów na skórę, ewentualnie używanie bandaża nieelastycznego.
- Używanie skarpetek z włókien naturalnych, nieuciskających, przewiewnych np. bambusowe, z jonami srebra.
- Stosowanie zalecanego obuwia i wkładek, dopasowanych indywidualnie do chorego. Obuwie powinno być tworzone z naturalnej, miękkiej skóry, z szerokim przodem i na twardej podeszwie. Obuwie powinno być o 1-2 numery większe od stopy. Przed ubraniem buta należy dokładnie sprawdzić jego wnętrze. Nowe buty powinno się nosić początkowo w domu i nie dłużej niż 3 godziny. Trzeba zwracać uwagę, aby zbyt mocno nie wiązać sznurówek. Wkładki do butów powinno się oceniać pod względem zużycia. Latem unikać chodzenia w klapkach i butach z odkrytym przodem. W zakresie doboru wkładek i obuwia najlepiej jest skonsultować się z podologiem i fizjoterapeutą.
- Codzienne ćwiczenia stóp, spacerowanie. Wyjątkiem są aktywne rany na stopach, wtedy w zaleceniach pacjent powinien odpoczywać i odciążać kończynę.
Leczenie stopy cukrzycowej
Każdą niepokojącą zmianę w obrębie stóp, pacjent powinien skonsultować z pielęgniarką, lekarzem, podologiem itd. Istotny jest czas wdrożenia odpowiedniej terapii. Dlatego im szybciej pacjent zareaguje, tym lepiej dla niego.
Obecnie rynek wyrobów medycznych zalecanych do terapii ran trudno gojących się, dysponuje całym wachlarzem nowoczesnych antyseptyków do dezynfekcji ran, opatrunków specjalistycznych, systemów odciążających stopy jak indywidualne wkładki lub obuwie odciążające odpowiednie obszary stopy objęte ranami. Dostępna jest także żywność specjalnego przeznaczenia medycznego jak Arginilan, Immuven, która dzięki wysokiej zawartości L-argininy, wspomaga proces regeneracji tkanek od wewnątrz. Należy wspomnieć, iż arginina jest prekursorem kolagenu, czyli budulca dla nowo tworzących się komórek, w tym blizny. Innymi składnikami, mającymi wpływ na szybkość gojenia ran są antyoksydanty jak witamina A i C, a także cynk czy kwasy omega-3. W holistycznej opiece nad pacjentem z zespołem stopy cukrzycowej należy nie tylko zadbać o zewnętrzne aspekty leczenia rany jak regularne jej oczyszczanie, dobór odpowiednich opatrunków aktywnych, dostosowanie właściwego odciążenia do lokalizacji i stopnia zaawansowania problemu. Nie mniej istotny jest aspekt dostarczenia pacjentowi składników budulcowych do wnętrza organizmu, przy jednoczesnej kontroli choroby podstawowej, czyli cukrzycy. Kontrola glikemii powinna towarzyszyć pacjentowi na każdym etapie leczenia, jak również prewencja innych powikłań cukrzycy jak retinopatia, nefropatia, incydenty sercowo-naczyniowe.
Podsumowanie
Cukrzyca jako choroba metaboliczna jest plagą dzisiejszych czasów. Oprócz kwestii genetycznej, która należy do czynników niepoddających się modyfikacji, na powstawanie cukrzycy ma duży wpływ styl życia. Niestety stres, otyłość, złe nawyki żywieniowe, brak ruchu, pośpiech – wpływają niekorzystnie na trzustkę, która z upływem czasu wydziela coraz to mniej insuliny, obniżającej poziom cukru we krwi. Z tego również względu do modelu opieki nad diabetykiem należy także modyfikacja powyższych czynników rozwoju choroby, które można poddać modyfikacji, a bez których ciężko o zadowalające efekty.
Autor: Magdalena Mróz
mgr pielęgniarstwa,
podolog, edukator w cukrzycy,
specjalista leczenia ran,
właścicielka poradni leczenia ran i podologii
eMMed w Rzeszowie.

Arginilan
Arginilan to żywność specjalnego przeznaczenia medycznego z innowacyjną formułą zawierającą wysoką porcję L-argininy, hydrolizatu kolagenu, a także wysoce przyswajalny cynk w postaci chelatu aminokwasowego Albion oraz witaminy A i C.
Jak zdiagnozować niedożywienie - poradnik
Jak zdiagnozować niedożywienie - PORADNIK
Szacuje się, że niedożywienie wywołane różnymi czynnikami dotknęło ponad miliard światowej populacji. Niedożywienie może być spowodowane zarówno zmniejszonym spożyciem i przyswajaniem składników odżywczych, ale w ostatnich latach zwraca się również uwagę na rolę chorób zapalnych i innych mechanizmów jego występowania. Niedożywienie związane z chorobą lub urazem, często składa się z połączenia zmniejszonego spożycia lub przyswajania pokarmu i różnego stopnia ostrego lub przewlekłego zapalenia, co prowadzi m.in. do zmian w składzie ciała. Zapalenie przyczynia się do występowania niedożywienia poprzez towarzyszącą anoreksję i zmniejszone spożycie pokarmu, jak również zmieniony metabolizm, któremu może towarzyszyć podniesiony spoczynkowy wydatek energetyczny i zwiększony katabolizm mięśni.
Jak diagnozować niedożywienie i na co zwracać uwagę, żeby do niego nie dopuścić?
KRYTERIA GLIM
W styczniu 2016 roku powołano grupę roboczą o nawie Global Leadership Initiative on Malnutrition (GLIM), której nadrzędnym celem stało się stworzenie uniwersalnych i globalnych kryteriów rozpoznawania niedożywienia i wskazań do żywienia klinicznego. Dotychczas brakowało spójnego konsensusu, a towarzystwa naukowe rekomendowały nierzadko nieco inne podejścia. GLIM została stworzona przez: Amerykańskie Towarzystwo Żywienia Pozajelitowego i Dojelitowego (ASPEN), Europejskie Towarzystwo Żywienia Pozajelitowego i Dojelitowego (ESPEN), Latynoamerykańską Federację Terapii Żywieniowej, Żywienia Klinicznego i Metabolizmu (FELANPE) oraz Towarzystwo Żywienia Pozajelitowego i Dojelitowego Azji (PENSA). Efektem prac grupy roboczej GLIM są nowe globalne kryteria diagnozowania niedożywienia, które zostały opublikowane w 2019 roku w czasopiśmie Clinical Nutrition ESPEN. Zaproponowano w nich trzyetapowe badanie stanu odżywienia.
PIERWSZY ETAP
Eksperci byli zgodni co do tego, że niezbędnym i kluczowym pierwszym krokiem w ocenie stanu odżywienia jest przesiewowe badanie, które pozwoli zidentyfikować ryzyko niedożywienia za pomocą dowolnego zwalidowanego kwestionariusza np. NRS 2002 (ang. Nutritional Risk Screening-2002), SGA (ang. Subjective Global Assessment), MUST (ang. Malnutrition Universal Screening Tool), MNA-SF (ang. Mini Nutritional Assessment-Short Form) i innych. W poniższej tabeli zaprezentowano przegląd najczęściej wykorzystywanych kwestionariuszy.
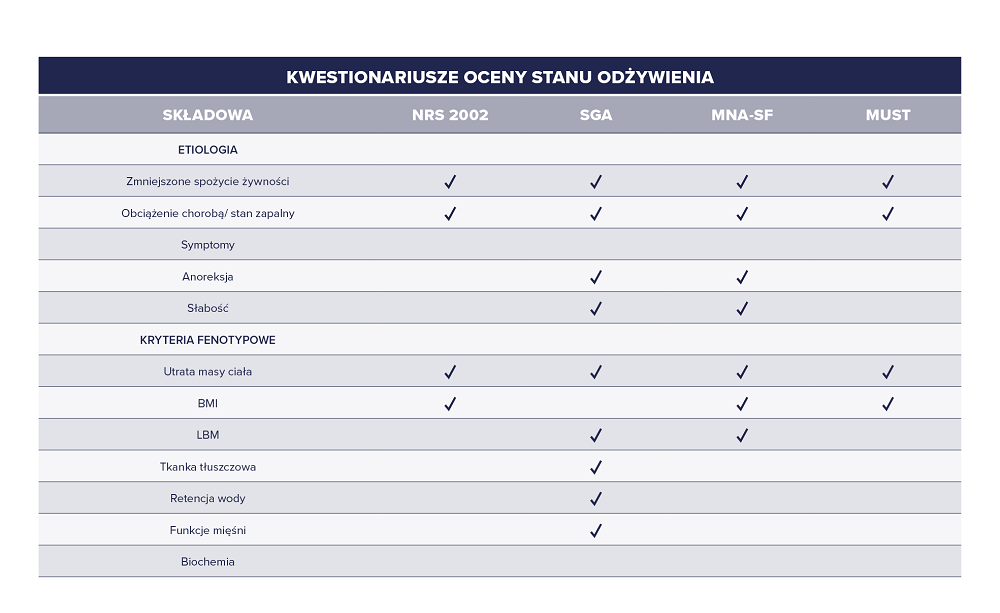
Zgodnie z polskim prawem badaniu przesiewowemu należy poddać wszystkie osoby hospitalizowane (wyjątek: SOR) za pomocą skali SGA lub NRS 2002. Skale zobaczysz po kliknięciu w nazwę.
DRUGI ETAP
Dodatni wynik przesiewowego testu wskazuje, że konieczna jest dalsza diagnostyka. Drugi etap służy potwierdzeniu rozpoznania niedożywienia. Zespół ekspertów wyróżnił pięć najważniejszych kryteriów (niezamierzona utrata masy ciała; niskie BMI; redukcja masy mięśniowej; zmniejszenie spożycia lub wchłaniania składników odżywczych; obciążenie chorobą/zapalenie), które podzielił na fenotypowe i etiologiczne (patrz rysunek poniżej). Zdiagnozowanie niedożywienia wymaga obecności przynajmniej jednego kryterium fenotypowego i jednego etiologicznego.

TRZECI ETAP
Służy ustaleniu stopnia ciężkości niedożywienia, które dokonuje się na podstawie kryteriów fenotypowych (patrz tabela poniżej). Uzyskany wyniki decyduje o podjęciu właściwych działań terapeutycznych.

Kryteria etiologiczne na tym etapie mają być pomoce w znalezieniu przyczyny, zaplanowania interwencji i ustalenia przewidywanych wyników leczenia. Eksperci zalecają wykorzystanie wcześniejszych wytycznych ESPEN i ASPEN, w których:
- niedożywieniu związanemu z przewlekłą chorobą towarzyszy przewlekły stan zapalny;
- niedożywieniu związanemu z przewlekłą chorobą towarzyszy stan zapalny o niewielkim nasileniu;
- niedożywieniu związanemu z ostrą chorobą lub urazem towarzyszy ciężki stan zapalny;
- niedożywieniu związanemu z ostrą chorobą lub urazem towarzyszy ciężki stan zapalny;
- niedożywieniu towarzyszy głodzenie obejmujące ograniczony dostęp do pożywienia.
Wiele prac naukowych dostarcza dowodów na to, że uzgodnione kryteria rozpoznawania niedożywienia są istotne i są w stanie przewidzieć niekorzystne skutki kliniczne wynikające ze stanu zdrowia pacjentów. Co ważne, stosowanie tych kryteriów w codziennej praktyce nie wymaga żmudnej i skomplikowanej edukacji i pozwala w łatwy sposób zidentyfikować pacjentów, którzy wymagają interwencji dietetycznej i leczenia żywieniowego.
Autor: Konrad Klekot
Bibliografia:
- Cederholm T, Barazzoni R, Austin P, Ballmer P, Biolo G, Bischoff SC, Compher C, Correia I, Higashiguchi T, Holst M, Jensen GL, Malone A, Muscaritoli M, Nyulasi I, Pirlich M, Rothenberg E, Schindler K, Schneider SM, de van der Schueren MA, Sieber C, Valentini L, Yu JC, Van Gossum A, Singer P. ESPEN guidelines on definitions and terminology of clinical nutrition. Clin Nutr. 2017 Feb;36(1):49-64.
- Cederholm T, Jensen GL, Correia MITD, Gonzalez MC, Fukushima R, Higashiguchi T, Baptista G, Barazzoni R, Blaauw R, Coats A, Crivelli A, Evans DC, Gramlich L, Fuchs-Tarlovsky V, Keller H, Llido L, Malone A, Mogensen KM, Morley JE, Muscaritoli M, Nyulasi I, Pirlich M, Pisprasert V, de van der Schueren MAE, Siltharm S, Singer P, Tappenden K, Velasco N, Waitzberg D, Yamwong P, Yu J, Van Gossum A, Compher C; GLIM Core Leadership Committee; GLIM Working Group. GLIM criteria for the diagnosis of malnutrition – A consensus report from the global clinical nutrition community. Clin Nutr. 2019 Feb;38(1):1-9.
- Lewandowicz-Umyszkiewicz M, Wieczorowska-Tobis K, New criteria for the diagnosis of malnutrition, Geriatria 2019; 13: 101-105.

Nutramil Complex
Produkt przeznaczony do postępowania dietetycznego u osób z niedożywieniem lub ryzykiem jego powstania. Posiłek pełnowartościowy może być stosowany jako jedyne źródło pożywienia.