CUKIER ŻYWI RAKA – FAKT, MIT czy PÓŁPRAWDA?
Żywienie w chorobie nowotworowej jest prężnie rozwijającą się dziedziną dietetyki klinicznej, w której bardzo często pojawia się wiele mitów lub półprawd traktowanych przez pacjentów, a czasem nawet przez personel medyczny jako pewnik. Stwierdzenie, że „cukier żywi raka” i powinien być bezwzględnie wyeliminowany z diety jest jednym z przykładów, o którym słyszała prawdopodobnie większość pacjentów onkologicznych. To wydawać by się mogło, proste stwierdzenie nie jest już takie łatwe do wytłumaczenia biorąc pod uwagę funkcjonowanie przewodu pokarmowego i metabolizm komórek nowotworowych. Czy cukier faktycznie sprawia, że komórki nowotworowe rosną szybciej? Jaki mechanizm za to odpowiada?
Glukoza – podstawowe źródło energii
Zanim dojedziemy do glukozy na początku warto przypomnieć sobie, kilka podstawowych, ale kluczowych informacji na temat węglowodanów, które są podstawowym składnikiem pokarmowym naszej diety, ponieważ dostarczamy ich w ciągu dnia ok. 200-500 g, co często stanowi >50% zapotrzebowania energetycznego. Są one również podstawowym źródłem energii dla wszystkich komórek ludzkiego organizmu.
Węglowodany dzieli się w zależności od wielkości i struktur cząsteczki na:
- monosacharydy – glukoza, fruktoza, galaktoza;
- oligosacharydy – składające się z 2-20 połączonych ze sobą monosacharydów, do nich zalicza się również dwucukry: sacharozę, laktozę, maltozę;
- polisacharydy – zawierające więcej niż 20 monosacharydów, a więc skrobia oraz glikogen.
Największe wątpliwości w chorobie nowotworowej budzą cukry proste, do których zaliczane są mono- i oligosacharydy, które stanowią szybkie źródło energii. Jednak, jeśli przyjrzyjmy się bliżej procesowi trawienia węglowodanów to okaże się, że polisacharydy (węglowodany złożone) również muszą zostać rozłożone do cukrów prostych, aby mogły być wchłonięte. Dla przykładu, w jamie ustnej i żołądku ulega strawieniu około 30-40% skrobi. Następnie proces trawienia kontynuowany jest w jelitach przy udziale amylazy trzustkowej i na powierzchni brzeżka szczoteczkowego enterocytów pod wpływem enzymów wytwarzanych przez enterocyty. Rozkład oligosacharydów jest połączony z natychmiastowym wchłanianiem przez eneterocyty produktów trawienia, którymi są w około 80% glukoza, w 15% fruktoza i w 5% galaktoza. Tak więc węglowodany złożone trawione są do cukrów prostych, ponieważ tylko w takiej postaci mogą zostać wchłonięte do organizmu. Co więcej, glukoza i fruktoza jest również składnikiem warzyw i owoców. Cząsteczki te nie różnią się niczym od cząsteczek glukozy i fruktozy, z których składa się sacharoza, czyli tzw. cukier stołowy. Nasz organizm nie posiada mechanizmów rozróżniających, które podpowiedziałby mu, np. że „to jest zdrowa glukoza z owoców, a ta jest niezdrowa ponieważ pochodzi z landrynek”, w krwiobiegu to po prostu niezbędna glukoza. Co więcej, glukoza jest zużywana przez większość komórek centralnego i obwodowego układu nerwowego, gojące się tkanki i komórki krwi. Nie bez przyczyny badanie stężenia glukozy w osoczu krwi żylnej jest jednym z podstawowych badań laboratoryjnych, ponieważ zarówno hipo- jak i hiperglikemia są niebezpieczne dla zdrowia. Szacuje się, że podczas spoczynku proces zużywania glukozy przez mózg jest jednym z głównych części wydatku energetycznego organizmu i stanowi nawet 20% spoczynkowej przemiany materii.
Jeśli więc unikasz spożycia cukrów prostych, dlatego żeby komórki nowotworowe się nią nie odżywiały to wiedz, że organizm i tak ją pozyska z węglowodanów złożonych bądź ze źródeł niecukrowych (proces glukoneogenzy).
Komórki nowotworowe, a glukoza
Prawdą jest, że komórki nowotworowe do utrzymania niekontrolowanego tempa wzrostu charakteryzują się odmiennym mechanizmem pozyskiwania energii ze składników odżywczych od komórek zdrowych. W normalnych warunkach glukoza jest utleniana do pirogronianu, który ulega procesowi dekarboksylacji i już w postaci acetylo-CoA wchodzi w cykl Krebsa. W komórkach nowotworowych, glukoza metabolizowana jest do mleczanu, który jest efektywnie wykorzystywany do tworzenia energii. Co ciekawe, w normalnych warunkach mleczan powstaje przy niewystarczającej ilości tlenu w komórce (oddychanie beztlenowe), a w komórkach nowotworowych glukoza metabolizowana jest do mleczanu nawet w warunkach tlenowych. To zjawisko zostało opisane w literaturze jako efekt Warburga (rys.1).
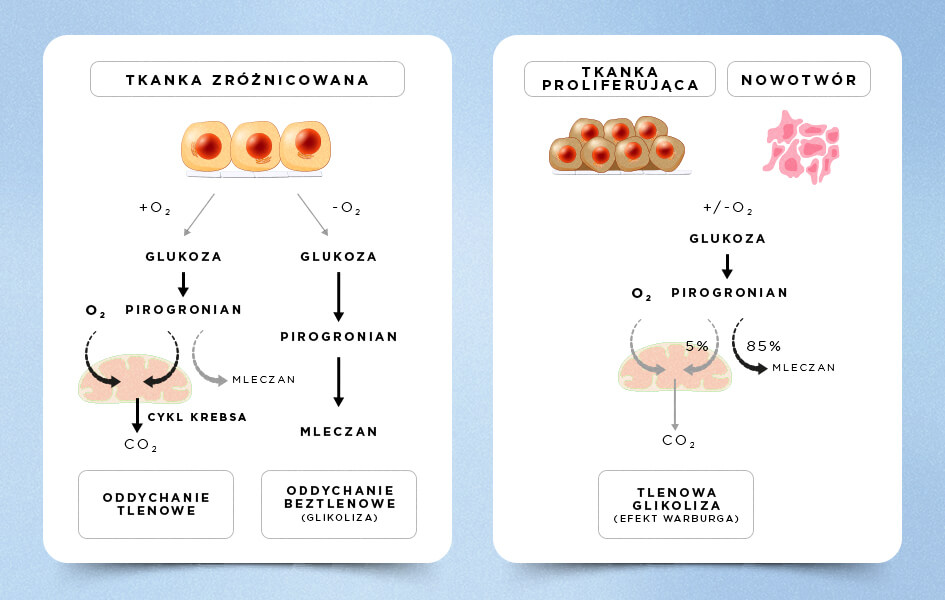
Rys. 1 Schemat przedstawiający różnicę pomiędzy metabolizmem glukozy pomiędzy zdrowymi komórkami (oddychanie tlenowe i beztlenowe), a komórkami szybko dzielącymi się (efekt Warburga). W komórkach nowotworowych 85% glukozy przekształcana jest do mleczanu nawet w obecności tlenu. Mitochondria w takich komórkach mogą pracować prawidłowo.
Ponadto, zwiększony wychwyt glukozy do komórek nowotworowych jest ułatwiony przez większą ilość błonowych transporterów glukozy, co może być istotnym markerem zmian nowotworowych w komórkach. Czasami w komórkach nowotworowych pojawiają się transportery dla glukozy, które nigdy nie występują w komórkach zdrowych. To wszystko sprawia, że napływa do nich nawet 20-30 razy więcej glukozy niż do komórek zdrowych. Jednak to też nie jest dobry argument, który powinien być wykorzystywany do stosowania diet niskowęglowodanowych lub ketogennych u pacjentów onkologicznych. Są bowiem prace, które sugerują, że ciała ketonowe mogą sprzyjać wzrostowi komórek nowotworowych i być wykorzystywane jako pomocniczy substrat energetyczny w tzw. odwrotnym efekcie Warburga, w którym zmienione nowotworowo komórki wpływają na fibroblasty podścieliska guza, nasilając w nich procesy rozpadu i produkując metabolity (ciała ketonowe, glutamina, mleczan), które następnie wykorzystywane są w komórkach nowotworowych do procesów anabolicznych, oddychania tlenowego, co jest konieczne do ich wzrostu i rozwoju. Dodatkowo dieta ketogenna może sprzyjać progresji nowotworów w obecności specyficznych mutacji onkogennych (BRAF V600e). W przeglądzie narracyjnym Oliveira i wsp., którego celem była analiza badań z udziałem ludzi z wykorzystaniem diety ketogennej, u pacjentów onkologicznych stwierdzono, że mimo, że występowanie efektu Warburga zauważa się w wielu różnych typach nowotworów przegląd wykazał brak dobrze zaprojektowanych i rygorystycznych badań oceniających wpływ określonych interwencji żywieniowych w leczeniu lub optymalizacji leczenia choroby nowotworowej. Potrzebne są dalsze badania, które pozwolą lepiej wyjaśnić wpływ diety ketogennej na stan odżywienia pacjentów, rokowania i ogólny stan zdrowia. Z powyższych względów drastyczna redukcja węglowodanów w diecie pacjentów onkologicznych nie jest aktualnie rekomendowana.
Co więcej, nie ma obecnie dowodów naukowych na to, że dieta wolna od cukrów obniża ryzyko rozwoju choroby nowotworowej lub zwiększa szanse przeżycia jeśli choroba zostanie zdiagnozowana. To oczywiście nie znaczy, że nie powinniśmy ograniczać spożycia cukrów prostych w diecie. Spożycie dużych ilości cukrów prostych może powodować przyrost masy ciała i prowadzić do nadwagi i otyłości, które zwiększają ryzyko występowanie 13 różnych typów nowotworów, czego nie można lekceważyć .
Podsumowując
Glukoza bez wątpienia jest jednym z głównych źródeł energii dla komórek nowotworowych, jednak jest niezbędna również do funkcjonowania zdrowych komórek i nawet eliminując ją z diety nie jesteśmy w stanie całkowicie obniżyć jej stężenia we krwi. Pamiętajmy, że węglowodany (w tym cukry) znajdziemy w owocach, warzywach i produktach pełnoziarnistych, które pomagają pacjentom utrzymać masę ciała i masę mięśniową podczas procesu leczenia, a ich codzienne spożycie zmniejsza ryzyko zachorowania na chorobę nowotworową. Wymienione produkty nie są jedynie źródłem węglowodanów, ale również błonnika, witamin, składników mineralnych i antyoksydantów. Stwierdzenie „CUKIER ŻYWI RAKA” jest półprawdą i bardzo dużym uproszczeniem, bardzo złożonego obszaru, który naukowcy dopiero poznają i na który wpływa wiele czynników. Przestrzeganie bardzo restrykcyjnych diet u pacjentów onkologicznych, którzy bardzo często są niedożywieni może na dłuższą metę utrudniać powrót do zdrowia, zmniejszać skuteczność leczenia, a nawet zagrażać życiu pacjentów.

Autor: Konrad Klekot
Bibliografia:
- Konturek SJ. Fizjologia człowieka. Podręcznik dla studentów medycyny. Elsevier Urban & Partner, Wydanie II, 2016.
- Sobotka L. i wsp. Podstawy żywienia klinicznego, Scientifica, Edycja IV, 2013.
- Gasińska A., Janecka A., Adamczyk A., Słonina D., How tumour cells respirate?, NOWOTWORY Journal of Oncology 2013, volume 63, number 2, 124–131.
- Szawłowski AW., Gromadzka-Ostrowska J., Paluszkiewicz P., Słodkowski M., Sobocki J. i wsp. Żywienie w chorobach nowotworowych, PZWL, Warszawa, 2020.
- Ancey PB, Contat C, Meylan E. Glucose transporters in cancer – from tumor cells to the tumor microenvironment. FEBS J. 2018 Aug;285(16):2926-2943.
- Barron CC, Bilan PJ, Tsakiridis T, Tsiani E. Facilitative glucose transporters: Implications for cancer detection, prognosis and treatment. Metabolism. 2016 Feb;65(2):124-39.
- Bonuccelli G, Tsirigos A, Whitaker-Menezes D, Pavlides S, Pestell RG, Chiavarina B, Frank PG, Flomenberg N, Howell A, Martinez-Outschoorn UE, Sotgia F, Lisanti MP. Ketones and lactate „fuel” tumor growth and metastasis: Evidence that epithelial cancer cells use oxidative mitochondrial metabolism. Cell Cycle. 2010 Sep 1;9(17):3506-14.
- Martinez-Outschoorn UE, Prisco M, Ertel A, Tsirigos A, Lin Z, Pavlides S, et al., Ketones and lactate increase cancer cell stemness, driving recurrence, metastasis and poor clinical outcome in breast cancer: achieving personalized medicine via metabolo-genomics, ABBV Cell Cycle 10 (2011) 1271–1286.
- Martinez-Outschoorn UE, Lin Z, Whitaker-Menezes D, Howell A, Sotgia F, Lisanti MP, Ketone body utilization drives tumor growth and metastasis, ABBV Cell Cycle 11 (2012) 3964–3971.
- Xia S, Lin R, Jin L, Zhao L, Kang HB, Pan Y, Liu S, Qian G, Qian Z, Konstantakou E, Zhang B, Dong JT, Chung YR, Abdel-Wahab O, Merghoub T, Zhou L, Kudchadkar RR, Lawson DH, Khoury HJ, Khuri FR, Boise LH, Lonial S, Lee BH, Pollack BP, Arbiser JL, Fan J, Lei QY, Chen J. Prevention of Dietary-Fat-Fueled Ketogenesis Attenuates BRAF V600E Tumor Growth. Cell Metab. 2017 Feb 7;25(2):358-373.
- Oliveira CLP, Mattingly S, Schirrmacher R, Sawyer MB, Fine EJ, Prado CM. A Nutritional Perspective of Ketogenic Diet in Cancer: A Narrative Review. J Acad Nutr Diet. 2018 Apr;118(4):668-688.
- Cancer.gov/obesity-fact-sheet

Nutramil Complex Protein
Żywność specjalnego przeznaczenia medycznego przeznaczona do stosowania w chorobie nowotworowej, w przypadku niedożywienia, problemów z gryzieniem i przełykaniem, w okresie okołooperacyjnym oraz we wszystkich stanach chorobowych ze zwiększonym zapotrzebowaniem na
białko.
Powiązane wpisy
Kacheksja nowotworowa – czym jest i jak leczyć?
Kacheksja to wyniszczenie organizmu, któremu towarzyszy znaczny spadek masy mięśniowej. Powstaje na skutek ciężkiej, przewlekłej choroby, schorzenia zakaźnego, a nawet uzależnienia. Najczęściej jest to jednak kacheksja nowotworowa (zwana również zespołem CAC), która jest następstwem zaawansowanego stadium rozwoju nowotworu.
Kto jest najbardziej narażony na powstawanie ran przewlekłych?
Rany przewlekłe to trudno gojące się rany, które bez specjalistycznego leczenia nie są w stanie się zabliźnić.
Jakie składniki odżywcze pomagają w procesie gojenia ran?
Zapewnienie odpowiednich składników odżywczych w diecie jest istotne dla prawidłowego procesu gojenia się ran.
Czy prehabilitacja ma wpływ na wystąpienie zakażenia miejsca operowanego?
Prehabilitacja to przygotowanie organizmu przed leczeniem także przedoperacyjnym, który ma na celu optymalizację stanu zdrowia przed zabiegiem. Wszystko po to, aby zabieg przebiegł bez komplikacji i powikłań a pacjent mógł szybciej wrócić do stanu sprzed choroby.
Utrata masy mięśniowej, a zdrowie pacjenta
Patofizjologia utraty masy mięśniowej w kontekście kacheksji, sarkopenii, niedożywienia jest procesem wieloczynnikowym i bardzo złożonym, obejmującym m.in. czynniki...
Poradnik Prehabilitacja
Koncepcja prehabilitacji powstała w celu poprawy jakości opieki świadczonej podczas prowadzonego procesu terapeutycznego.
Poradnik Żywieniowy cz.2
Odżywianie chorych jest bardzo ważną składową postępowania terapeutycznego i powinno być dostosowane do indywidualnych potrzeb i stanu pacjenta.
Poradnik – Prehabilitacja. Leczenie onkologiczne. Nowotwory głowy i szyi.
Gojenie rany to wieloetapowy i często skomplikowany proces, wymagający odpowiedniego zaopatrzenia w tlen i substancje odżywcze. Organizmowi niedożywionemu znacznie trudniej będzie zregenerować powstałe zmiany skórne, dlatego należy pamiętać o jakże istotnym znaczeniu żywienia.
Co przynieść choremu do szpitala?
Wybierasz się na wizytę do szpitala do bliskiej Ci osoby? Zastanawiasz się, co możesz przynieść do jedzenia w upominku, co nie zaszkodzi w procesie rekonwalescencji i będzie dobrze przyswajalne?
Chemioterapia i radioterapia a nietolerancja laktozy – czy ma to związek?
Czy chemioterapia i radioterapia mają wpływ na tolerancję laktozy u chorego? Czy dietoterapia w onkologii ma sens?
Jak odżywiać mikrobiotę jelitową?
Mikrobiota jest bardzo istotna w każdym organizmie, dlatego powinniśmy o nią wyjątkowo dbać - nie narażać ją na zbyt duży wysiłek metaboliczny. Czym jest mikrobiota jelitowa i jak ją odpowiednio ożywiać?
Jaka jest rola probiotyków w chorobach zapalnych jelit?
Probiotyki to żywe mikroorganizmy, które wprowadzane w odpowiedniej ilości i formie, korzystnie wpływają na zdrowie organizmu. W przypadku chorób zapalnych jelit, probiotyki mogą mieć pozytywny wpływ na stan zapalny oraz regenerację błony śluzowej jelit.
Mity w diecie osoby chorej na nowotwór
Czy istnieje dieta, która mogłaby całkowicie ochronić przed zachorowaniem na nowotwór? Czy istnieje dieta lecząca i wspomagająca leczenie?
Białko niszczy nerki – FAKT, MIT czy PÓŁPRAWDA?
Powszechnie wiadomo, że ograniczenie spożycia białka w diecie zalecane jest u pacjentów z przewlekłą niewydolnością nerek bez leczenia nerkozastępczego. Stwierdzenie to może rodzić pytanie:
Interwencja żywieniowa u pacjenta z trudno gojącymi się ranami
Opieka nad ranami wymaga wielokierunkowej i często długotrwałej terapii, w trakcie której należy uwzględnić wiele czynników, mających wpływ na prawidłowe wygojenie rany.
Poradnik Żywieniowy
Niedożywienie występuje najczęściej u pacjentów w wieku podeszłym (50%), pacjentów z chorobami
układu oddechowego (45%), chorobami zapalnymi jelit (80%) i nowotworami złośliwymi (85%).
Poradnik Żywieniowy w procesie leczenia ran
Gojenie rany to wieloetapowy i często skomplikowany proces, wymagający odpowiedniego zaopatrzenia w tlen i substancje odżywcze. Organizmowi niedożywionemu znacznie trudniej będzie zregenerować powstałe zmiany skórne, dlatego należy pamiętać o jakże istotnym znaczeniu żywienia.
Talerz bariatryczny – czyli jak komponować posiłki?
Otyłość to choroba, którą można leczyć na wiele sposobów. Jeśli natomiast mówimy o otyłości olbrzymiej, tutaj najczęściej dochodzi do operacyjnego leczenia, czyli operacji bariatrycznej. Tylko jak po takiej operacji utrzymać efekt na dłużej? Co jeść, aby cały proces leczenia był skuteczny?
Zasady żywienia po resekcji żołądka
Zasady żywienia po resekcji żołądka (inaczej gastrektomii) można porównać do rozszerzania diety u niemowląt. Pacjentowi rekomenduje się ostrożne wprowadzanie niewielkich ilości poszczególnych pokarmów, uważnie obserwując swoją tolerancję.
Poradnik – Prehabilitacja. Choroby zapalne jelit.
Gojenie rany to wieloetapowy i często skomplikowany proces, wymagający odpowiedniego zaopatrzenia w tlen i substancje odżywcze. Organizmowi niedożywionemu znacznie trudniej będzie zregenerować powstałe zmiany skórne, dlatego należy pamiętać o jakże istotnym znaczeniu żywienia.
Jak zdiagnozować niedożywienie – poradnik
Szacuje się, że niedożywienie wywołane różnymi czynnikami dotknęło ponad miliard światowej populacji. Niedożywienie może być spowodowane zarówno zmniejszonym spożyciem i przyswajaniem składników odżywczych, ale w ostatnich latach zwraca się również uwagę na rolę chorób zapalnych i innych mechanizmów jego występowania.
Czy dieta wysokobiałkowa „niszczy” mikrobiotę jelitową?
W ostatnich latach wiele mówi się o mikrobiocie jelitowej, która czynnie uczestniczy w metabolizmie spożywanego wraz z dietą białka. Fakt ten rodzi istotne z punktu widzenia zdrowia pacjentów pytania np. jak duża ilość białka w diecie wpływa na mikrobiotę jelitową i czy z tej perspektywy zwiększenie ilości tego makroskładnika jest bezpieczne dla pacjentów?