Czy dieta wysokobiałkowa "niszczy" mikrobiotę jelitową?
Nie ulega wątpliwości, że białko jest jednym z najważniejszych składników odżywczych u wyniszczonych pacjentów, ponieważ jest zaangażowane w naprawę i regenerację komórek, potrzebne do produkcji enzymów i hormonów, a także uczestniczy w procesie krzepnięcia krwi. W ostatnich latach wiele mówi się o mikrobiocie jelitowej, która czynnie uczestniczy w metabolizmie spożywanego wraz z dietą białka. Fakt ten rodzi istotne z punktu widzenia zdrowia pacjentów pytania np. jak duża ilość białka w diecie wpływa na mikrobiotę jelitową i czy z tej perspektywy zwiększenie ilości tego makroskładnika jest bezpieczne dla pacjentów?
Co dzieje się z białkiem po spożyciu?
Przeważająca część spożytego białka jest trawiona do aminokwasów i/lub peptydów i w tej postaci wchłaniana jest w jelicie cienkim. Jednak szacuje się, że około 10% spożytego białka nie ulega całkowitemu strawieniu i przechodzi do jelita grubego, gdzie podlega proteolizie przez bytujące tam drobnoustroje. Biorąc pod uwagę powyższe informacje, można spodziewać się, że wraz ze wzrostem białka w diecie zwiększa się odsetek niestrawionych białek osiągających jelito grube, prowadząc do produkcji różnych metabolitów bakteryjnych m.in. krótkołańcuchowych kwasów tłuszczowych (SCFA), amoniaku, poliamin, związków fenolowych oraz indolowych, czy siarkowodoru, które biorą udział w różnych funkcjach fizjologicznych i mogą mieć korzystny bądź szkodliwy wpływ na gospodarza w zależności od ich stężenia (Rycina 1). W niektórych pracach naukowych możemy spotkać się z wnioskami, które wskazują na związek między stężeniem wybranych metabolitów, a np. przewlekłym stanem zapalnym lub zwiększonym ryzykiem nowotworu jelita grubego. Warto pamiętać, że korelacja nie wskazuje na związek przyczynowo-skutkowy, a jedynie na współwystępowanie dwóch zmiennych, co oznacza, że na podstawie korelacji nie jesteśmy w stanie stwierdzić, że to zwiększona ilość białka była przyczyną występowania danej jednostki chorobowej.
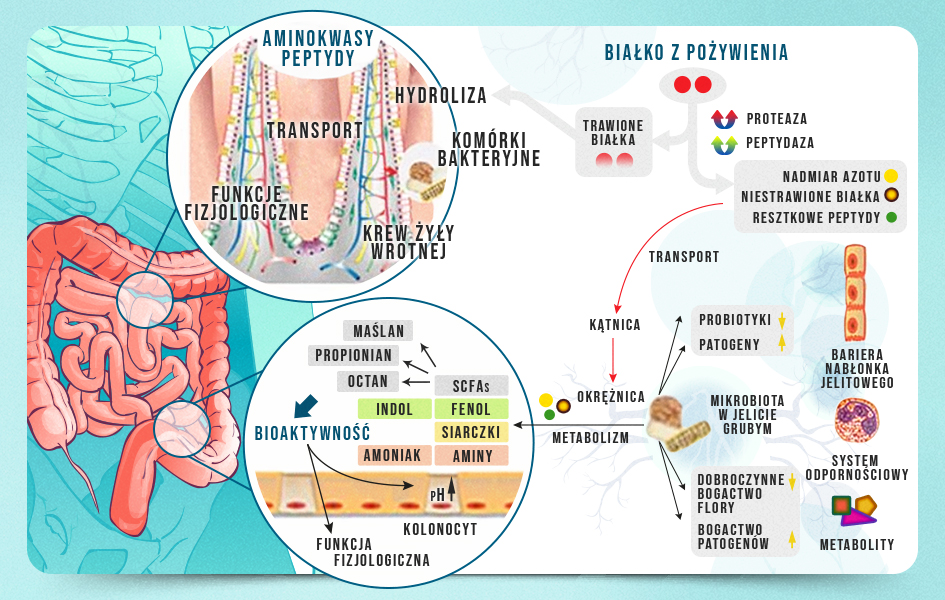
Rycina 1. Losy białka w przewodzie pokarmowym (na podstawie Zhao J. et al. 2019).
Wybrane bakteryjne metabolity fermentacji białek
Krótkołańcuchowe kwasy tłuszczowe (SCFA)
Produkcja SCFA obejmujących octan, propionian i maślan pochodzi przede wszystkim ze spożycia niestrawnych węglowodanów i zachodzi podczas fermentacji bakteryjnej w okrężnicy. Jednakże niestrawione białka są również substratami do produkcji SCFA. Dla przykładu octan może być produkowany przez drobnoustroje jelitowe z glicyny, alaniny, treoniny, glutaminianu, lizyny i asparaginianu; maślan z glutaminianu i lizyny; propionian z alaniny i treoniny. Ilość oraz rodzaj produkowanych SCFA zależy głównie od czasu pasażu jelitowego, składu mikrobioty jelitowej oraz od dostępności substratu. Wiemy, że SCFA są utlenianie i zużywane przez nabłonek okrężnicy. Ponadto mogą aktywować białka odgrywające ważną rolę w modulacji odkładania się tkanki tłuszczowej i wchłaniania składników odżywczych w jelicie. Dodatkowo SCFA biorą udział w różnych procesach fizjologicznych i spełniają ważną rolę w utrzymaniu integralności jelit, regulacji apetytu czy homeostazie glukozy.
Amoniak
Fermentacja białek w jelicie grubym może prowadzić do powstawania związków azotowych takich jak amoniak, czy aminy. Gdy produkty te przekroczą stężenie fizjologiczne, mogą odrywać rolę toksycznych substancji. Stężenie amoniaku w jelicie grubym wiąże się głównie z deaminacją aminokwasów (usunięcie grupy aminowej aminokwasów) i hydrolizą mocznika. Mikrobiota jelitowa używa amoniaku i może on być również wchłaniany przez komórki nabłonka. Mimo że amoniak jest znany ze swoich toksycznych właściwości, to jest również źródłem azotu dla drobnoustrojów bytujących w jelicie grubym. Większość amoniaku jest wydalana z kałem lub wchłaniana w jelitach i wydalana wraz z moczem.
Poliaminy
Są cząsteczkami wytwarzanymi przez kolonocyty z niektórych aminokwasów – arginina, ornityna, metionina, tyrozyna czy histydyna. Drobnoustroje bytujące w okrężnicy mogą wytwarzać różne poliaminy np. agmatynę, putrescynę, kadawerynę, histaminę oraz tyraminę, które biorą udział w aktywności komórkowej drobnoustrojów w zakresie wzrostu, proliferacji, transportu i wydzielania. W konsekwencji skład mikrobioty jelitowej jest jednym z czynników wpływających na profil poliamin obecnych w jelicie grubym.
Siarkowodór
Stanowi rodzaj metabolitu wytwarzanego przez fermentację aminokwasów siarkowych – metioniny i cysteiny. Bakterie jelitowe mogą czerpać energię z łańcucha węglowego cysteiny przez enzym desulfhydrazę cysteinową, natomiast metionina może zostać przekształcona w α-ketomaślan, amoniak, czy metanotiol. Wytwarzanie tych metabolitów przypisuje się określonej grupie taksonomicznej bakterii obecnym w jelicie grubym m.in. Escherichia coli, Salmonella enterica, Clostridium spp. i Enterobacter aerogenes. Siarkowodór jest mocno toksycznym metabolitem, dlatego jego stężenie w świetle okrężnicy jest na poziomie milimolowym. Różne eksperymenty głównie w warunkach in vitro wykazały m.in., że siarkowodór w nadmiernych stężeniach może hamować oddychanie komórkowe w kolonocytach, uszkadzać DNA, czy hamować utlenianie maślanu w komórkach jelita grubego. Powyższe doniesienia mogą sugerować, że siarkowodór podobnie jak amoniak działa niekorzystnie na kolonocyty, jednak dokładniejsza analiza jego funkcji pokazuje, że jego działanie jest zdecydowanie bardziej złożone. Siarczki w odpowiednim stężeniu mogą wspomagać gojenie wrzodów i wywierać działanie przeciwzapalne. Ponadto obserwuje się mitochondrialne utlenianie siarczków, które utrzymywane jest tak długo jak przepływ siarczków nie przekracza komórkowej zdolności utleniania, co z kolei sugeruje, że siarkowodór stanowi pierwsze „paliwo mineralne” dla ludzkich kolonocytów.
Fenole i indole
Mogą powstawać z metabolizmu aminokwasów aromatycznych (fenyloalaniny, tyrozyny i tryptofanu) w jelicie grubym i są podejrzewane o promowanie procesu nowotworzenia. Rodzaje bakterii beztlenowych znanych z fermentacji aminokwasów aromatycznych obejmują Bacteroides, Lactobacillus, Bifidobacterium, Clostridium i Peptostreptococcus. Mogą one wytwarzać szereg związków fenolowych i indolowych m.in. p-krezol, skatol, indol, fenol.
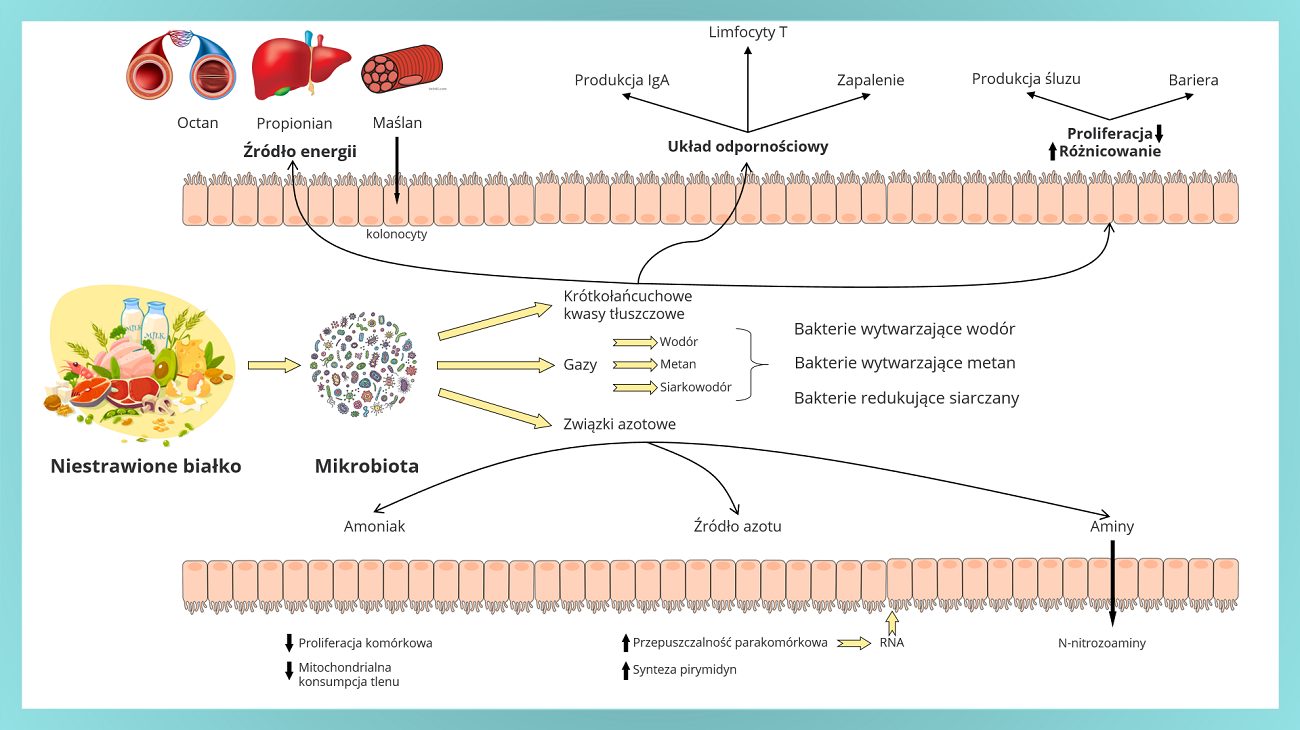
Rycina 2. Białko pokarmowe, jego metabolity i mechanizm homeostazy jelit. SCFA mogą być utleniane i wykorzystywane jako energia dla komórek okrężnicy. Oprócz roli w metabolizmie energetycznym są również ważnymi modulatorami układu odpornościowego, sprzyjają wytwarzaniu śluzu i zachowaniu bariery jelitowej. Produkcja gazów takich jak metan, wodór, siarkowodór wiąże się ze zmianą bakterii fermentacyjnych, które odgrywają kluczową rolę w systemach beztlenowych. Dodatkowo działanie związków azotu można podsumować jako hamowanie proliferacji komórkowej, konsumpcji tlenu oraz aktywację syntezy pirymidyn i zwiększanie przepuszczalności parakomórkowej (na podstawie Ma i wsp. 2017).
Czy rodzaj białka ma znaczenie?
Z przedstawionych wyżej danych wynika, że mikrobiota jelitowa ma dużą moc proteolityczną, co zostało przedstawione m.in. w pracy Macfarlane i Cummings jeszcze w 1986 roku. Badania przeprowadzone na modelach zwierzęcych wykazały większą różnorodność mikrobiologiczną u zwierząt karmionych białkami pochodzenia roślinnego w porównaniu do zwierząt karmionych białkami podchodzenia zwierzęcego oraz zwiększoną liczebność rzędu Bacteroidales S24-7 u zwierząt otrzymujących karmę z białkiem sojowym. Li i wsp. oceniali wpływ diety wysokobiałkowej i niskowęglowodanowej u psów i zanotowali obniżony stosunek rodzaju Bacteroides do Prevotella oraz zwiększoną liczebność Clostridium hiranonis, Clostridium perfringens i Ruminococcus gnavus. Zasugerowano, że ostatnie z wymienionych bakterii mogą mieć korzystne działanie w ludzkich jelitach.
Również w badaniach z udziałem ludzi spożycie białka zostało dodatnio skorelowane z różnorodnością mikrobioty jelitowej. Dane te pochodzą z badań przeprowadzonych na zdrowych ochotnikach, sportowcach oraz osobach z nadwagą i otyłością. Również w tych eksperymentach źródło białka wydaje się mieć znaczenie, ponieważ w przypadku podaży białek pochodzenia roślinnego zanotowano większą liczebność: Bifidobacterium, Lactobacillus, Roseburia, Eubacterium rectale, oraz Ruminococcus bromii, natomiast mniejszą liczebność Bacteroides i Clostridium perfringens. Spożycie białek pochodzenia zwierzęcego wiązało się wyższą liczebnością Bacteroides, Alistipes, Bilophila i Clostridium perfrigens.
Wysoka liczebność Bacteroides została odnotowana u osób spożywających typową dietę zachodnią, bogatą w białko i tłuszcze zwierzęce, jednak sugeruje się, że to właśnie różnice w zawartości tłuszczu, a nie białka są głównym czynnikiem wzrostu tego rodzaju bakterii. Warto dodać, że odnotowano istotne zależności pomiędzy zwiększonym stężeniem SCFA w kale, Prevotella i niektórych Firmicutes, a spożywaniem diety śródziemnomorskiej. Dieta ta cechuje się mniejszą zawartością białka zwierzęcego, ale jednocześnie wyższym odsetkiem białka roślinnego, a co najważniejsze wysoką zawartością błonnika, który jest jednym z kluczowych czynników przyczyniających się do zachowania różnorodności mikrobioty jelitowej. Warto podkreślić, że większość źródeł białka roślinnego jest również bogata w błonnik, podczas gdy białko pochodzenia zwierzęcego niekoniecznie, dlatego jest wysoce prawdopodobne, że to właśnie błonnik jest głównym czynnikiem wpływającym na różnorodność mikrobioty jelitowej w przeprowadzonych pracach.
Co w takim razie z osobami chorymi?
Mikrobiom jelitowy pacjentów w stanie krytycznym różni się od tego u osób zdrowych. Zmiany fizjologiczne związane z przebiegiem choroby prowadzą do głębokich zmian w składzie i funkcjach mikrobiomu jelitowego, co może być związane z aktywacją układu immunologicznego i progresją niewydolności narządów. Badania wykazały, że u pacjentów w stanie krytycznym może dojść do prawie całkowitej utraty prozdrowotnej mikrobioty wraz z przerostem zjadliwych patogenów.
Suplementacja wysokoenergetyczną i wysokobiałkową żywnością specjalnego przeznaczenia medycznego (taką jak Nutramil Complex® Protein), bez wątpienia może przynosić korzyści dla pacjentów, szczególnie jeśli chodzi poprawę stanu odżywienia, czy częściową ochronę przed spadkiem beztłuszczowej masy ciała. Dysponujemy jednak ograniczonym zasobem badań naukowych, które pozwoliłby dokładnie scharakteryzować możliwą modulację tych efektów przez mikrobiotę jelitową. Większość dotychczasowych prac oceniała prawie wyłącznie skład mikrobioty jelitowej, a nie jej pojemność funkcjonalną mikrobiomu. Ocena różnic w genach drobnoustrojów zaangażowanych w metabolizm białka pomiędzy osobami różniącymi się odpowiedzią anaboliczną na podaż białka może doprowadzić do opracowania nowych probiotyków o specyficznej zdolności do wpływania na syntezę białek mięśniowych.
Białko, seniorzy i mikrobiom
W badaniu Ford i wsp. (2020), którego celem była ocena wpływu spożycia diety wysokobiałkowej (1,5-2,2 g/kg/dzień) bez probiotyku i z probiotykiem u starszych kobiet, stwierdzono, że dieta wysokobiałkowa nie wpływała na zmianę składu mikrobioty jelitowej w okresie dwóch tygodni. W innym badaniu Sergeev i wsp. (2020) wykazali, że utrata masy ciała u osób stosujących wysokobiałkową, niskowęglowodanową i ubogoenergetyczną dietę wiąże się ze zmianami w mikrobiocie jelitowej. Stosowanie synbiotyku zwiększało liczebność Bifidobacterium i Lactobacillus podczas wprowadzonego programu redukcji masy ciała opierającego się na wysokobiałkowej i niskowęglowadanowej diecie w porównaniu z grupą przyjmującą placebo. Ponadto, w kilku pracach wykazano, że wysokobiałkowe, ale niskowęglowodanowe diety u osób otyłych powodują zmniejszenie liczebności Roseburia i Eubacterium rectale, odpowiedzialnych za produkcję maślanu. Co ciekawe, wyniki tych prac wskazują, że zmieniony skład mikrobioty jelitowej jest wywoływany przez obniżenie spożycia węglowodanów w diecie, a nie tylko przez podwyższenie spożycia białka. Dysponujemy jednak pracami na modelu zwierzęcym sugerującymi, że zwiększona ilość białka w diecie w przeciwieństwie do jego umiarkowanego spożycia powoduje zmiany w składzie mikrobioty jelitowej – obniżenie liczebności bakterii rodzajów Roseburia, Faecalibacterium i Clostridium XIVa odpowiedzialnych za produkcję maślanu, a także zwiększona ilość Firmicutes. Wyniki niektórych badań zostały podsumowane w poniższej tabeli 1.
Tabela 1. Zmiany w mikrobiocie jelitowej i zmiany metaboliczne po dietach wysokobiałkowych i niskowęglowodanowych.
Przedstawione wyżej dane sugerują, że dostępność węglowodanów złożonych może zmniejszyć fermentację białka, prowadząc do pozyskiwania większej ilości substratów azotowych, które mogą promować anabolizm mięśni u seniorów. Wydaje się, że zadbanie o odpowiednie dostarczanie węglowodanów złożonych szczególnie podczas spożywania diety wysokobiałkowej może mieć kluczowe znaczenie nie tylko dla zdrowia metabolicznego, ale również dla zdrowia mięśni szkieletowych.
Podsumowanie
Niestrawione białko i aminokwasy są fermentowane do różnych metabolitów mogących wywierać zarówno pozytywny jak i negatywny wpływ na zdrowie gospodarza. Proces ten jest w dużym stopniu uzależniony od ich stężenia w świetle jelita, potencjału działania i wielu innych czynników, do których można zaliczyć np. rodzaj spożywanego białka, czy ilość węglowodanów w diecie.
Strategie żywieniowe ukierunkowane na modulację mikrobioty jelitowej wydają się być użytecznym narzędziem do poprawy zdrowia przewodu pokarmowego, jednak na tę chwilę posiadamy zbyt małą liczbę badań nad wpływem białka na mikrobiotę jelitową, aby móc dokładnie wyjaśnić związek między funkcją drobnoustrojów, a zdrowiem jelit. Ponadto, większość badań została przeprowadzona w warunkach in vitro i na modelach zwierzęcych, co oznacza, że ekstrapolacja tych wyników na pacjentów jest kłopotliwa. W końcu powstaje jedno z kluczowych pytań, czy biorąc pod uwagę wszystkie za i przeciw ograniczenie spożycia pełnowartościowego białka w grupie pacjentów z niedożywieniem białkowo-kalorycznym jest dobrym rozwiązaniem, nawet jeśli część białka miałaby ulec fermentacji do wymienionych w artykule metabolitów?
Autor: Konrad Klekot
Literatura:
1. Zhao J, Zhang X, Liu H, Brown MA, Qiao S. Dietary Protein and Gut Microbiota Composition and Function. Curr Protein Pept Sci. 2019;20(2):145-154.
2. Rowland I, Gibson G, Heinken A, Scott K, Swann J, Thiele I, Tuohy K. Gut microbiota functions: metabolism of nutrients and other food components. Eur J Nutr. 2018 Feb;57(1):1-24.
3. Ma N, Tian Y, Wu Y, Ma X. Contributions of the Interaction Between Dietary Protein and Gut Microbiota to Intestinal Health. Curr Protein Pept Sci. 2017;18(8):795-808.
4. Li Q., Lauber C.L., Czarnecki-Maulden G., Pan Y., Hannah S.S. Effects of the dietary protein and carbohydrate ratio on gut microbiomes in dogs of different body conditions. MBio. 2017;8:1–14.
5. Ni Lochlainn M, Bowyer RCE, Steves CJ. Dietary Protein and Muscle in Aging People: The Potential Role of the Gut Microbiome. Nutrients. 2018 Jul 20;10(7):929.
6. Ford AL, Nagulesapillai V, Piano A, Auger J, Girard SA, Christman M, Tompkins TA, Dahl WJ. Microbiota Stability and Gastrointestinal Tolerance in Response to a High-Protein Diet with and without a Prebiotic, Probiotic, and Synbiotic: A Randomized, Double-Blind, Placebo-Controlled Trial in Older Women. J Acad Nutr Diet. 2020 Apr;120(4):500-516.e10.
7. Prokopidis K, Cervo MM, Gandham A, Scott D. Impact of Protein Intake in Older Adults with Sarcopenia and Obesity: A Gut Microbiota Perspective. Nutrients. 2020 Jul 30;12(8):2285.
8. Sergeev I.N., Aljutaily T., Walton G., Huarte E. Effects of synbiotic supplement on human gut microbiota, body composition and weight loss in obesity. Nutrients. 2020;12:222.
9. Duncan S.H., Belenguer A., Holtrop G., Johnstone A.M., Flint H.J., Lobley G.E. Reduced dietary intake of carbohydrates by obese subjects results in decreased concentrations of butyrate and butyrate-producing bacteria in feces. Appl. Environ. Microbiol. 2007;73:1073–1078.
10. Vidal-Lletjos S., Andriamihaja M., Blais A., Grauso M., Lepage P., Davila A.M., Viel R., Gaudichon C., Leclerc M., Blachier F., et al. Dietary protein intake level modulates mucosal healing and mucosa-adherent microbiota in mouse model of colitis. Nutrients. 2019;11:514.
11. Russell W.R., Gratz S.W., Duncan S.H., Holtrop G., Ince J., Scobbie L., Duncan G., Johnstone A.M., Lobley G.E., Wallace R.J., et al. High-protein, reduced-carbohydrate weight-loss diets promote metabolite profiles likely to be detrimental to colonic health. Am. J. Clin. Nutr. 2011;93:1062–1072.
12. Rowland I, Gibson G, Heinken A, Scott K, Swann J, Thiele I, Tuohy K. Gut microbiota functions: metabolism of nutrients and other food components. Eur J Nutr. 2018 Feb;57(1):1-24.
13. Yang Q, Liang Q, Balakrishnan B, Belobrajdic DP, Feng QJ, Zhang W. Role of Dietary Nutrients in the Modulation of Gut Microbiota: A Narrative Review. Nutrients. 2020 Jan 31;12(2):381.

Nutramil Complex Protein
Preparat wysokobiałkowy do stosowania przy niedożywieniu, w chorobie nowotworowej, w okresie okołooperacyjnym, w czasie rekonwalescencji, w chorobach układu pokarmowego.
Powiązane wpisy
Poradnik Żywieniowy cz.2
Odżywianie chorych jest bardzo ważną składową postępowania terapeutycznego i powinno być dostosowane do indywidualnych potrzeb i stanu pacjenta.
Utrata masy mięśniowej, a zdrowie pacjenta
Patofizjologia utraty masy mięśniowej w kontekście kacheksji, sarkopenii, niedożywienia jest procesem wieloczynnikowym i bardzo złożonym, obejmującym m.in. czynniki...
Jak zdiagnozować niedożywienie – poradnik
Szacuje się, że niedożywienie wywołane różnymi czynnikami dotknęło ponad miliard światowej populacji. Niedożywienie może być spowodowane zarówno zmniejszonym spożyciem i przyswajaniem składników odżywczych, ale w ostatnich latach zwraca się również uwagę na rolę chorób zapalnych i innych mechanizmów jego występowania.
Cukier żywi raka – FAKT, MIT czy PÓŁPRAWDA?
Żywienie w chorobie nowotworowej jest prężnie rozwijającą się dziedziną dietetyki klinicznej, w której bardzo często pojawia się wiele mitów lub półprawd traktowanych przez pacjentów, a czasem nawet przez personel medyczny jako pewnik.
Wsparcie żywieniowe pacjenta po COVID-19
Pacjenci ciężko przechodzący COVID-19 są podatni na znaczną utratę masy ciała i kacheksję, będących wynikiem niedożywienia, jak również złożonych zmian metabolicznych.
Czy prehabilitacja ma wpływ na wystąpienie zakażenia miejsca operowanego?
Prehabilitacja to przygotowanie organizmu przed leczeniem także przedoperacyjnym, który ma na celu optymalizację stanu zdrowia przed zabiegiem. Wszystko po to, aby zabieg przebiegł bez komplikacji i powikłań a pacjent mógł szybciej wrócić do stanu sprzed choroby.
Zasady żywienia po resekcji żołądka
Zasady żywienia po resekcji żołądka (inaczej gastrektomii) można porównać do rozszerzania diety u niemowląt. Pacjentowi rekomenduje się ostrożne wprowadzanie niewielkich ilości poszczególnych pokarmów, uważnie obserwując swoją tolerancję.
Niedożywienie w przewlekłym zapaleniu trzustki
Czy chemioterapia i radioterapia mają wpływ na tolerancję laktozy u chorego? Czy dietoterapia w onkologii ma sens?
Plan działania żywieniowego w chorobach nowotworowych głowy i szyi.
Czy chemioterapia i radioterapia mają wpływ na tolerancję laktozy u chorego? Czy dietoterapia w onkologii ma sens?
Co przynieść choremu do szpitala?
Wybierasz się na wizytę do szpitala do bliskiej Ci osoby? Zastanawiasz się, co możesz przynieść do jedzenia w upominku, co nie zaszkodzi w procesie rekonwalescencji i będzie dobrze przyswajalne?
Poradnik Żywieniowy w procesie leczenia ran
Gojenie rany to wieloetapowy i często skomplikowany proces, wymagający odpowiedniego zaopatrzenia w tlen i substancje odżywcze. Organizmowi niedożywionemu znacznie trudniej będzie zregenerować powstałe zmiany skórne, dlatego należy pamiętać o jakże istotnym znaczeniu żywienia.
Poradnik Prehabilitacja
Koncepcja prehabilitacji powstała w celu poprawy jakości opieki świadczonej podczas prowadzonego procesu terapeutycznego.
Kto jest najbardziej narażony na powstawanie ran przewlekłych?
Rany przewlekłe to trudno gojące się rany, które bez specjalistycznego leczenia nie są w stanie się zabliźnić.
Jak odżywiać mikrobiotę jelitową?
Mikrobiota jest bardzo istotna w każdym organizmie, dlatego powinniśmy o nią wyjątkowo dbać - nie narażać ją na zbyt duży wysiłek metaboliczny. Czym jest mikrobiota jelitowa i jak ją odpowiednio ożywiać?
Interwencja żywieniowa u pacjenta z trudno gojącymi się ranami
Opieka nad ranami wymaga wielokierunkowej i często długotrwałej terapii, w trakcie której należy uwzględnić wiele czynników, mających wpływ na prawidłowe wygojenie rany.
Poradnik – Prehabilitacja. Leczenie onkologiczne. Nowotwory głowy i szyi.
Gojenie rany to wieloetapowy i często skomplikowany proces, wymagający odpowiedniego zaopatrzenia w tlen i substancje odżywcze. Organizmowi niedożywionemu znacznie trudniej będzie zregenerować powstałe zmiany skórne, dlatego należy pamiętać o jakże istotnym znaczeniu żywienia.
Mity w diecie osoby chorej na nowotwór
Czy istnieje dieta, która mogłaby całkowicie ochronić przed zachorowaniem na nowotwór? Czy istnieje dieta lecząca i wspomagająca leczenie?
Jaka jest rola probiotyków w chorobach zapalnych jelit?
Probiotyki to żywe mikroorganizmy, które wprowadzane w odpowiedniej ilości i formie, korzystnie wpływają na zdrowie organizmu. W przypadku chorób zapalnych jelit, probiotyki mogą mieć pozytywny wpływ na stan zapalny oraz regenerację błony śluzowej jelit.
Talerz bariatryczny – czyli jak komponować posiłki?
Otyłość to choroba, którą można leczyć na wiele sposobów. Jeśli natomiast mówimy o otyłości olbrzymiej, tutaj najczęściej dochodzi do operacyjnego leczenia, czyli operacji bariatrycznej. Tylko jak po takiej operacji utrzymać efekt na dłużej? Co jeść, aby cały proces leczenia był skuteczny?
Poradnik – Prehabilitacja. Okiem farmaceuty.
Gojenie rany to wieloetapowy i często skomplikowany proces, wymagający odpowiedniego zaopatrzenia w tlen i substancje odżywcze. Organizmowi niedożywionemu znacznie trudniej będzie zregenerować powstałe zmiany skórne, dlatego należy pamiętać o jakże istotnym znaczeniu żywienia.
Dlaczego warto żywić pacjenta z chorobą nowotworową?
Odpowiednio zbilansowana dieta dostarcza do organizmu niezbędnych składników odżywczych (m.in. węglowodanów, tłuszczów, białka, witamin, składników mineralnych). Dzięki temu organizm człowieka ma siłę do przeprowadzenia wszystkich procesów w odpowiedni sposób.
Białko niszczy nerki – FAKT, MIT czy PÓŁPRAWDA?
Powszechnie wiadomo, że ograniczenie spożycia białka w diecie zalecane jest u pacjentów z przewlekłą niewydolnością nerek bez leczenia nerkozastępczego. Stwierdzenie to może rodzić pytanie: