Białko niszczy nerki – FAKT, MIT czy PÓŁPRAWDA?
Białko niszczy nerki – FAKT, MIT czy PÓŁPRAWDA?
Powszechnie wiadomo, że ograniczenie spożycia białka w diecie zalecane jest u pacjentów z przewlekłą niewydolnością nerek bez leczenia nerkozastępczego.
Stwierdzenie to może rodzić pytanie:
– Czy wysokobiałkowe diety odgrywają jakąś rolę w rozwoju przewlekłej niewydolności nerek?
Utarło się sądzić, że spożycie dużych ilości białka szkodzi również prawidłowo funkcjonującym nerkom, dlatego w niniejszym artykule znajduje się przegląd literatury na ten temat.
Od czego się zaczęło?
W 1982 roku na łamach prestiżowego czasopisma naukowego The New England Journal of Medicine została opublikowana praca Brenner i wsp., w której zasugerowano, że przy długotrwałym stosowaniu diety wysokobiałkowej dochodzi do zwiększenia potencjalnego obciążenia osmotycznego nerek, co jest etapem prowadzącym do kompensacyjnej hiperfiltracji, która następnie prowadzi do uszkodzenia kłębuszków nerkowych i niewydolności nerek [1]. Późniejsze badania na modelu zwierzęcym zasugerowały, że stosowanie diety niskobiałkowej
i niskoenergetycznej osłabiło rozwój przewlekłej niewydolności nerek występującej wraz z wiekiem u zwierząt [2,3]. Do dzisiejszego dnia, przywoływane są wnioski z tych prac przez zwolenników hipotezy o szkodliwym wpływie białka na nerki.
Jaki jest problem z powyższymi badaniami?
Już w 1992 Walser podważył wyniki pochodzące z tych prac sugerując, że mechanizm powstawania przewlekłej niewydolności nerek w modelu zwierzęcym różni się od tego zachodzącego u ludzi. Dla przykładu, rozwój przewlekłej choroby nerek u starych szczurów jest powszechny. Ponadto, dominującą zmianą występującą w modelu zwierzęcym jest stwardnienie kłębuszków nerkowych, podczas gdy u ludzi przewlekła niewydolność nerek związana jest głównie ze spadkiem filtracji kłębuszkowej przez nefrony [4]. Oczywiście na potwierdzenie tych argumentów są prace naukowe. W 1991 roku Lew i Bosch, wykazali, że dieta z obniżoną zawartością białka sprzyja obniżaniu współczynnika przesączania kłębuszkowego (GFR), zamiast go zwiększać i jeśli spożycie białka nie jest kontrolowane widoczny spadek GFR wraz z wiekiem będzie wyolbrzymiony, ponieważ osoby starsze spożywają mniejsze ilości białka od osób młodych [5,6].
Co na to nowsza literatura naukowa?
Dowody naukowe sprzed lat zostały potwierdzone w nowych pracach naukowych. Metaanaliza 30 badań z 2160 uczestnikami opracowana przez Schwingshackl i Hoffmann (2014), której celem było zbadanie wpływu wysokobiałkowej diety w porównaniu z dietą normobiałkową/niskobiałkową na parametry czynności nerek u osób bez przewlekłej niewydolności nerek stwierdza, że stosowanie diety wysokobiałkowej było związane ze zwiększonym GFR, mocznikiem w surowicy, wydalaniem wapnia z moczem i stężeniem kwasu moczowego. Większość z tych zmian można interpretować jako fizjologiczny mechanizm adaptacyjny wywoływany stosowaniem diety wysokobiałkowej bez żadnego znaczenia klinicznego [7]. Bardzo podobne wnioski płyną z metaanalizy opracowanej przez Devries i wsp. (2018), której celem było określenie wpływu spożywania diety wysokobiałkowej (~1,8 g/kg m.c.) na funkcjonowanie nerek u zdrowych dorosłych osób w porównaniu do diety z normalną lub niższą zawartością białka (~0,93 g/kg m.c.). Do pracy włączono 28 badań z 1358 uczestnikami. We wnioskach tej pracy można przeczytać, że dieta wysokobiałkowa nie miała niekorzystnego wpływu na współczynnik GFR u zdrowych dorosłych osób [8].
Podsumowanie
Dane te są zgodne ze stanowiskiem WHO oraz Institute of Medicine na temat spożycia białka i funkcji nerek [9,10]. Aktualnie nie ma dowodów naukowych, które wskazywałby, że spożywanie dużej ilości białka prowadzi do pogorszenia czynności nerek u osób zdrowych i jak wskazuje metaanaliza Devries i wsp. nawet w populacjach osób o większym ryzyku pogorszenia czynności nerek, takich jak osoby z cukrzycą typu 2. Ponadto, biorąc pod uwagę zalety spożycia produktów wysokobiałkowych w celu poprawy regeneracji, wspierania przyrostu masy mięśniowej, zahamowania spadku masy mięśniowej w okresie starzenia, stwierdzenie, że dieta wysokobiałkowa nie wpłynie negatywnie na funkcjonowanie nerek osób zdrowych wydaje się mieć duże znaczenie.

Autor: Konrad Klekot
Bibliografia:
- Brenner BM, Meyer TW, Hostetter TH. Dietary protein intake and the progressive nature of kidney disease: the role of hemodynamically mediated glomerular injury in the pathogenesis of progressive glomerular sclerosis in aging, renal ablation, and intrinsic renal disease. N Engl J Med. 1982 Sep 9;307(11):652-9.
- Anderson S, Brenner BM. 1986. Effects of aging on the renal glomerulus. Am J Med. 80:435–442.
- Anderson S, Brenner BM. 1987. The aging kidney: Structure, function, mechanisms, and therapeutic implications. J Am Geriatr Soc 35:590–593.
- Walser M. 1992. The relationship of dietary protein to kidney disease. In: Liepa GU, Beitz DC, Beynen AC, Gorman MA, eds. Dietary Proteins: How They Alleviate Disease and Promote Be
- Lew, S.Q., and J.P. Bosch. 1991. Effect of diet on creatinine clearance and excretion in young and elderly healthy subjects and in patients with renal disease. J. Am. Soc. Nephrol. 2:856-865.
- Kerr, G.R., E. S. Lee, M.-K.M. Lam, R.J. Lorimor, E. Randall, R.N. Forthofer, M.A. Davis, and S.M. Magnetti. 1982. Relationships between dietary and biochemical measures of nutritional status in HANES I data. Am. J. Clin. Nutr. 35:294-308.
- Schwingshackl L, Hoffmann G. Comparison of high vs. normal/low protein diets on renal function in subjects without chronic kidney disease: a systematic review and meta-analysis. PLoS One. 2014 May 22;9(5):e97656.
- Devries MC, Sithamparapillai A, Brimble KS, Banfield L, Morton RW, Phillips SM. Changes in Kidney Function Do Not Differ between Healthy Adults Consuming Higher- Compared with Lower- or Normal-Protein Diets: A Systematic Review and Meta-Analysis. J Nutr. 2018 Nov 1;148(11):1760-1775.
- WHO; FAO; UN University Protein and amino acid requirements in human nutrition: report of a joint FAO/WHO/UNU expert consultation. World Health Organ Tech Rep Ser; 2007;935, p. 224.
- Institute of Medicine Dietary Reference Intakes for energy, carbohydrate, fiber, fat, fatty acids, cholesterol, protein, and amino acids. Washington (DC): National Academies Press; 2005.

Immuven
Produkt zawiera składniki wspierające układ immunologiczny oraz proces gojenia ran. Zalecany w okresie okołooperacyjnym przed zabiegiem, po urazach.
Cukier żywi raka – FAKT, MIT czy PÓŁPRAWDA?
CUKIER ŻYWI RAKA – FAKT, MIT czy PÓŁPRAWDA?
Żywienie w chorobie nowotworowej jest prężnie rozwijającą się dziedziną dietetyki klinicznej, w której bardzo często pojawia się wiele mitów lub półprawd traktowanych przez pacjentów, a czasem nawet przez personel medyczny jako pewnik. Stwierdzenie, że „cukier żywi raka” i powinien być bezwzględnie wyeliminowany z diety jest jednym z przykładów, o którym słyszała prawdopodobnie większość pacjentów onkologicznych. To wydawać by się mogło, proste stwierdzenie nie jest już takie łatwe do wytłumaczenia biorąc pod uwagę funkcjonowanie przewodu pokarmowego i metabolizm komórek nowotworowych. Czy cukier faktycznie sprawia, że komórki nowotworowe rosną szybciej? Jaki mechanizm za to odpowiada?
Glukoza – podstawowe źródło energii
Zanim dojedziemy do glukozy na początku warto przypomnieć sobie, kilka podstawowych, ale kluczowych informacji na temat węglowodanów, które są podstawowym składnikiem pokarmowym naszej diety, ponieważ dostarczamy ich w ciągu dnia ok. 200-500 g, co często stanowi >50% zapotrzebowania energetycznego. Są one również podstawowym źródłem energii dla wszystkich komórek ludzkiego organizmu.
Węglowodany dzieli się w zależności od wielkości i struktur cząsteczki na:
- monosacharydy – glukoza, fruktoza, galaktoza;
- oligosacharydy – składające się z 2-20 połączonych ze sobą monosacharydów, do nich zalicza się również dwucukry: sacharozę, laktozę, maltozę;
- polisacharydy – zawierające więcej niż 20 monosacharydów, a więc skrobia oraz glikogen.
Największe wątpliwości w chorobie nowotworowej budzą cukry proste, do których zaliczane są mono- i oligosacharydy, które stanowią szybkie źródło energii. Jednak, jeśli przyjrzyjmy się bliżej procesowi trawienia węglowodanów to okaże się, że polisacharydy (węglowodany złożone) również muszą zostać rozłożone do cukrów prostych, aby mogły być wchłonięte. Dla przykładu, w jamie ustnej i żołądku ulega strawieniu około 30-40% skrobi. Następnie proces trawienia kontynuowany jest w jelitach przy udziale amylazy trzustkowej i na powierzchni brzeżka szczoteczkowego enterocytów pod wpływem enzymów wytwarzanych przez enterocyty. Rozkład oligosacharydów jest połączony z natychmiastowym wchłanianiem przez eneterocyty produktów trawienia, którymi są w około 80% glukoza, w 15% fruktoza i w 5% galaktoza. Tak więc węglowodany złożone trawione są do cukrów prostych, ponieważ tylko w takiej postaci mogą zostać wchłonięte do organizmu. Co więcej, glukoza i fruktoza jest również składnikiem warzyw i owoców. Cząsteczki te nie różnią się niczym od cząsteczek glukozy i fruktozy, z których składa się sacharoza, czyli tzw. cukier stołowy. Nasz organizm nie posiada mechanizmów rozróżniających, które podpowiedziałby mu, np. że „to jest zdrowa glukoza z owoców, a ta jest niezdrowa ponieważ pochodzi z landrynek”, w krwiobiegu to po prostu niezbędna glukoza. Co więcej, glukoza jest zużywana przez większość komórek centralnego i obwodowego układu nerwowego, gojące się tkanki i komórki krwi. Nie bez przyczyny badanie stężenia glukozy w osoczu krwi żylnej jest jednym z podstawowych badań laboratoryjnych, ponieważ zarówno hipo- jak i hiperglikemia są niebezpieczne dla zdrowia. Szacuje się, że podczas spoczynku proces zużywania glukozy przez mózg jest jednym z głównych części wydatku energetycznego organizmu i stanowi nawet 20% spoczynkowej przemiany materii.
Jeśli więc unikasz spożycia cukrów prostych, dlatego żeby komórki nowotworowe się nią nie odżywiały to wiedz, że organizm i tak ją pozyska z węglowodanów złożonych bądź ze źródeł niecukrowych (proces glukoneogenzy).
Komórki nowotworowe, a glukoza
Prawdą jest, że komórki nowotworowe do utrzymania niekontrolowanego tempa wzrostu charakteryzują się odmiennym mechanizmem pozyskiwania energii ze składników odżywczych od komórek zdrowych. W normalnych warunkach glukoza jest utleniana do pirogronianu, który ulega procesowi dekarboksylacji i już w postaci acetylo-CoA wchodzi w cykl Krebsa. W komórkach nowotworowych, glukoza metabolizowana jest do mleczanu, który jest efektywnie wykorzystywany do tworzenia energii. Co ciekawe, w normalnych warunkach mleczan powstaje przy niewystarczającej ilości tlenu w komórce (oddychanie beztlenowe), a w komórkach nowotworowych glukoza metabolizowana jest do mleczanu nawet w warunkach tlenowych. To zjawisko zostało opisane w literaturze jako efekt Warburga (rys.1).
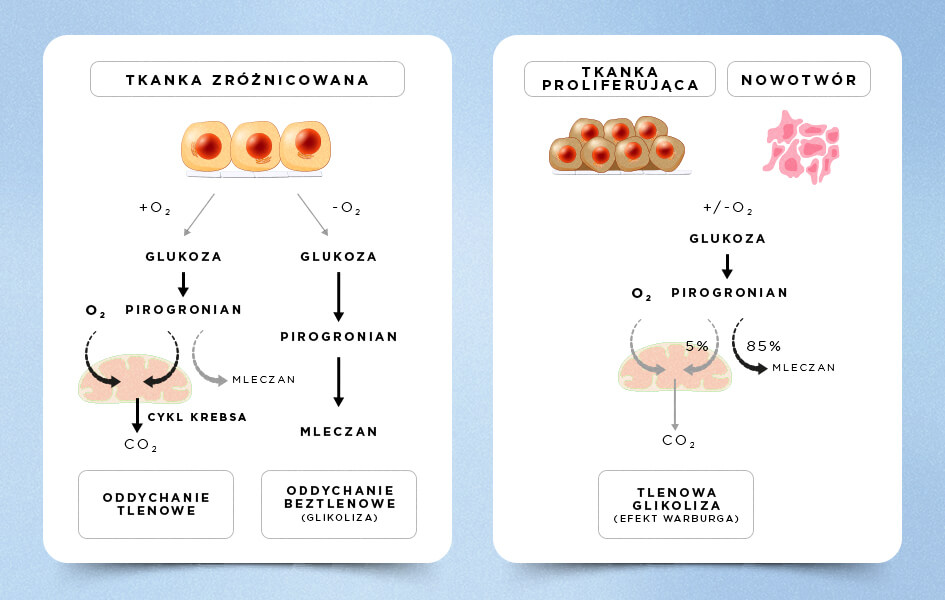
Rys. 1 Schemat przedstawiający różnicę pomiędzy metabolizmem glukozy pomiędzy zdrowymi komórkami (oddychanie tlenowe i beztlenowe), a komórkami szybko dzielącymi się (efekt Warburga). W komórkach nowotworowych 85% glukozy przekształcana jest do mleczanu nawet w obecności tlenu. Mitochondria w takich komórkach mogą pracować prawidłowo.
Ponadto, zwiększony wychwyt glukozy do komórek nowotworowych jest ułatwiony przez większą ilość błonowych transporterów glukozy, co może być istotnym markerem zmian nowotworowych w komórkach. Czasami w komórkach nowotworowych pojawiają się transportery dla glukozy, które nigdy nie występują w komórkach zdrowych. To wszystko sprawia, że napływa do nich nawet 20-30 razy więcej glukozy niż do komórek zdrowych. Jednak to też nie jest dobry argument, który powinien być wykorzystywany do stosowania diet niskowęglowodanowych lub ketogennych u pacjentów onkologicznych. Są bowiem prace, które sugerują, że ciała ketonowe mogą sprzyjać wzrostowi komórek nowotworowych i być wykorzystywane jako pomocniczy substrat energetyczny w tzw. odwrotnym efekcie Warburga, w którym zmienione nowotworowo komórki wpływają na fibroblasty podścieliska guza, nasilając w nich procesy rozpadu i produkując metabolity (ciała ketonowe, glutamina, mleczan), które następnie wykorzystywane są w komórkach nowotworowych do procesów anabolicznych, oddychania tlenowego, co jest konieczne do ich wzrostu i rozwoju. Dodatkowo dieta ketogenna może sprzyjać progresji nowotworów w obecności specyficznych mutacji onkogennych (BRAF V600e). W przeglądzie narracyjnym Oliveira i wsp., którego celem była analiza badań z udziałem ludzi z wykorzystaniem diety ketogennej, u pacjentów onkologicznych stwierdzono, że mimo, że występowanie efektu Warburga zauważa się w wielu różnych typach nowotworów przegląd wykazał brak dobrze zaprojektowanych i rygorystycznych badań oceniających wpływ określonych interwencji żywieniowych w leczeniu lub optymalizacji leczenia choroby nowotworowej. Potrzebne są dalsze badania, które pozwolą lepiej wyjaśnić wpływ diety ketogennej na stan odżywienia pacjentów, rokowania i ogólny stan zdrowia. Z powyższych względów drastyczna redukcja węglowodanów w diecie pacjentów onkologicznych nie jest aktualnie rekomendowana.
Co więcej, nie ma obecnie dowodów naukowych na to, że dieta wolna od cukrów obniża ryzyko rozwoju choroby nowotworowej lub zwiększa szanse przeżycia jeśli choroba zostanie zdiagnozowana. To oczywiście nie znaczy, że nie powinniśmy ograniczać spożycia cukrów prostych w diecie. Spożycie dużych ilości cukrów prostych może powodować przyrost masy ciała i prowadzić do nadwagi i otyłości, które zwiększają ryzyko występowanie 13 różnych typów nowotworów, czego nie można lekceważyć .
Podsumowując
Glukoza bez wątpienia jest jednym z głównych źródeł energii dla komórek nowotworowych, jednak jest niezbędna również do funkcjonowania zdrowych komórek i nawet eliminując ją z diety nie jesteśmy w stanie całkowicie obniżyć jej stężenia we krwi. Pamiętajmy, że węglowodany (w tym cukry) znajdziemy w owocach, warzywach i produktach pełnoziarnistych, które pomagają pacjentom utrzymać masę ciała i masę mięśniową podczas procesu leczenia, a ich codzienne spożycie zmniejsza ryzyko zachorowania na chorobę nowotworową. Wymienione produkty nie są jedynie źródłem węglowodanów, ale również błonnika, witamin, składników mineralnych i antyoksydantów. Stwierdzenie „CUKIER ŻYWI RAKA” jest półprawdą i bardzo dużym uproszczeniem, bardzo złożonego obszaru, który naukowcy dopiero poznają i na który wpływa wiele czynników. Przestrzeganie bardzo restrykcyjnych diet u pacjentów onkologicznych, którzy bardzo często są niedożywieni może na dłuższą metę utrudniać powrót do zdrowia, zmniejszać skuteczność leczenia, a nawet zagrażać życiu pacjentów.

Autor: Konrad Klekot
Bibliografia:
- Konturek SJ. Fizjologia człowieka. Podręcznik dla studentów medycyny. Elsevier Urban & Partner, Wydanie II, 2016.
- Sobotka L. i wsp. Podstawy żywienia klinicznego, Scientifica, Edycja IV, 2013.
- Gasińska A., Janecka A., Adamczyk A., Słonina D., How tumour cells respirate?, NOWOTWORY Journal of Oncology 2013, volume 63, number 2, 124–131.
- Szawłowski AW., Gromadzka-Ostrowska J., Paluszkiewicz P., Słodkowski M., Sobocki J. i wsp. Żywienie w chorobach nowotworowych, PZWL, Warszawa, 2020.
- Ancey PB, Contat C, Meylan E. Glucose transporters in cancer – from tumor cells to the tumor microenvironment. FEBS J. 2018 Aug;285(16):2926-2943.
- Barron CC, Bilan PJ, Tsakiridis T, Tsiani E. Facilitative glucose transporters: Implications for cancer detection, prognosis and treatment. Metabolism. 2016 Feb;65(2):124-39.
- Bonuccelli G, Tsirigos A, Whitaker-Menezes D, Pavlides S, Pestell RG, Chiavarina B, Frank PG, Flomenberg N, Howell A, Martinez-Outschoorn UE, Sotgia F, Lisanti MP. Ketones and lactate „fuel” tumor growth and metastasis: Evidence that epithelial cancer cells use oxidative mitochondrial metabolism. Cell Cycle. 2010 Sep 1;9(17):3506-14.
- Martinez-Outschoorn UE, Prisco M, Ertel A, Tsirigos A, Lin Z, Pavlides S, et al., Ketones and lactate increase cancer cell stemness, driving recurrence, metastasis and poor clinical outcome in breast cancer: achieving personalized medicine via metabolo-genomics, ABBV Cell Cycle 10 (2011) 1271–1286.
- Martinez-Outschoorn UE, Lin Z, Whitaker-Menezes D, Howell A, Sotgia F, Lisanti MP, Ketone body utilization drives tumor growth and metastasis, ABBV Cell Cycle 11 (2012) 3964–3971.
- Xia S, Lin R, Jin L, Zhao L, Kang HB, Pan Y, Liu S, Qian G, Qian Z, Konstantakou E, Zhang B, Dong JT, Chung YR, Abdel-Wahab O, Merghoub T, Zhou L, Kudchadkar RR, Lawson DH, Khoury HJ, Khuri FR, Boise LH, Lonial S, Lee BH, Pollack BP, Arbiser JL, Fan J, Lei QY, Chen J. Prevention of Dietary-Fat-Fueled Ketogenesis Attenuates BRAF V600E Tumor Growth. Cell Metab. 2017 Feb 7;25(2):358-373.
- Oliveira CLP, Mattingly S, Schirrmacher R, Sawyer MB, Fine EJ, Prado CM. A Nutritional Perspective of Ketogenic Diet in Cancer: A Narrative Review. J Acad Nutr Diet. 2018 Apr;118(4):668-688.
- Cancer.gov/obesity-fact-sheet

Nutramil Complex Protein
Żywność specjalnego przeznaczenia medycznego przeznaczona do stosowania w chorobie nowotworowej, w przypadku niedożywienia, problemów z gryzieniem i przełykaniem, w okresie okołooperacyjnym oraz we wszystkich stanach chorobowych ze zwiększonym zapotrzebowaniem na
białko.
Utrata masy mięśniowej, a zdrowie pacjenta
Utrata masy mięśniowej, a zdrowie pacjenta
Patofizjologia utraty masy mięśniowej w kontekście kacheksji, sarkopenii, niedożywienia jest procesem wieloczynnikowym i bardzo złożonym, obejmującym m.in. czynniki: hormonalne, neurologiczne, związane z wiekiem, specyficzne dla danej jednostki chorobowej, czy funkcjonalne. Odpowiednie żywienie jest kluczowym elementem odpowiadającym za wspieranie procesów anabolicznych mięśni (procesy budowy), osłabiającym procesy kataboliczne (procesy rozpadu) i poprawiającym prognozę pacjentów. Niestety, samo odżywianie nie jest w stanie całkowicie odwrócić kacheksji, ale w pewnym stopniu może złagodzić jej objawy oraz poprawić jakość życia i ogólne wyniki pacjentów.
Dlaczego masa mięśniowa jest tak istotna?
Mięśnie szkieletowe są niezbędnym narządem umożliwiającym poruszanie się; przyczyniającym się do metabolizmu całego ciała oraz stanowiącym główne miejsce wykorzystania spożywanych aminokwasów (pobieranie oraz utylizacja). Biorąc pod uwagę, że mięśnie stanowią ok. 40% masy całego ciała, redukcja ich liczebności zwiększa prawdopodobieństwo występowania powikłań zdrowotnych, co prowadzi do obniżenia jakości życia. Wraz z wiekiem spada również funkcja i masa mięśni szkieletowych co nazywamy sarkopenią. Jest to złożony stan prowadzący do zwiększonego ryzyka upadków, złamań, osłabienia, co w konsekwencji wiąże się z większym ryzykiem hospitalizacji, a ta potęguje spadek masy mięśniowej z powodu unieruchomienia, zmniejszonej aktywności fizycznej i nieoptymalnego żywienia. Ponadto, długoterminowe konsekwencje utraty masy mięśniowej obejmują: upośledzenie sprawności ruchowej, rozwój chorób oraz zwiększone ryzyko przedwczesnej śmierci. Warto również dodać, że implikacje finansowe sarkopenii stanowią poważne wyzwanie dla systemu opieki zdrowotnej. Z powyższych powodów rozwój i ochrona mięśni szkieletowych przez całe życie powinny być głównym celem osób pragnących zdrowo się starzeć z mniejszym ryzykiem powikłań zdrowotnych, które zdecydowanie wykraczają poza spadek mobilności.
U pacjentów liczy się świadomość, czas i konsekwencja
Kluczem do skutecznej interwencji żywieniowej jest jej wczesny początek oraz jej późniejsza kontynuacja. Utrata masy mięśniowej jest charakterystyczną cechą sarkopenii i kacheksji, a dodatkowo następuje błyskawicznie u pacjentów przewlekle chorych. Niestety odbudowa utraconej masy mięśniowej nie jest już taka prosta i niejednokrotnie potrzeba do tego wielu tygodni lub miesięcy pracy. Warto również dodać, że w większości przypadków masa mięśniowa pacjentów nigdy nie zostaje odbudowana do wartości sprzed pobytu w szpitalu. Sytuację tę świetnie zobrazowała dr Carla Prado, która porównała pobyt w szpitalu do pożaru lasu, natomiast powrót do zdrowia do ponownego jego zalesiania.

Używając tej przenośni, wczesna interwencja pozwala pacjentowi nie tylko na zalesienie większej ilości terenu, która może zadziałać jak bufor funkcjonalny w okresie choroby, ale również na szybką reakcję po zakończeniu pożaru. Z punktu widzenia żywieniowego takie interwencje mogą obejmować żywność, doustne suplementy odżywcze, czy żywienie dojelitowe lub pozajelitowe, o czym będzie mowa w kolejnych wpisach. Istotne jest by taki sposób działania uwzględniał zmieniające się potrzeby metaboliczne każdej osoby. Fundamentalną rolę odgrywa również edukacja pacjentów, ponieważ bardzo często nie uznają oni żywienia jako części procesu terapeutycznego.
O czym pamiętać, aby pomóc sobie lub swoim pacjentom?
- Organizm potrzebuje białka do budowy i utrzymania masy mięśniowej, gojenia tkanek, oraz do prawidłowego funkcjonowania układu odpornościowego.
- Niektóre schorzenia mogą wpływać na apetyt pacjentów, dlatego pacjenci często nie zaspokajają zapotrzebowania na białko.
- Spożywanie pokarmów bogatych w białko może pomóc zaspokoić zapotrzebowanie na ten makroskładnik i utrzymać siłę.
- Zjadaj 5-6 posiłków dziennie i włączaj do nich produkty bogate w białko. Jeśli istnieje taka potrzeba sięgnij po żywność specjalnego przeznaczenia medycznego – Nutramil Complex® Protein.
- Staraj się spożywać 1.2 – 1.5 g białka na kg masy ciała na dzień. Poniżej znajduje się tabelka ile białka powinieneś spożywać przy swojej masie ciała.
Referencje:
Prado CM, Anker SD, Coats AJS, Laviano A, von Haehling S. Nutrition in the spotlight in cachexia, sarcopenia and muscle: avoiding the wildfire. J Cachexia Sarcopenia Muscle. 2020 Dec 31. doi: 10.1002/jcsm.12673.
McKendry J, Thomas ACQ, Phillips SM. Muscle Mass Loss in the Older Critically Ill Population: Potential Therapeutic Strategies. Nutr Clin Pract. 2020 Aug;35(4):607-616. doi: 10.1002/ncp.10540.

Nutramil Complex
Produkt przeznaczony do postępowania dietetycznego u osób z niedożywieniem lub ryzykiem jego powstania. Posiłek pełnowartościowy może być stosowany jako jedyne źródło pożywienia.




